
OSTRUITA DEFECAZIONE: DEFINIZIONE
La sindrome da ostruita defecazione (ODS) è una condizione abbastanza frequente che interessa principalmente pazienti di sesso femminile con un impatto rilevante sulla qualità della vita.
Helen Martelli ha descritto per la prima volta la fisiopatologia di tale sindrome e l’ha identificata nell’ambito degli scenari della stipsi cronica[1].
Nei criteri di ROMA III del 1999, infatti, la ODS è definita come una condizione caratterizzata da due o più dei seguenti sintomi per almeno dodici settimane: defecazione difficile con sforzi defecatori, feci secche e dure, sensazione di defecazione incompleta, tenesmo, necessità di eseguire manovre manuali per facilitare la defecazione e/o meno di 3 defecazioni a settimana in almeno il 25% delle defecazioni[2].
L’ODS può essere dovuta sia a disturbi funzionali che organici/anatomici. I primi includono ansia, mancato rilassamento del muscolo puborettale durante la defecazione, riduzione della sensibilità rettale e cause neurologiche. I disturbi organici includono il prolasso rettale, l’intussuscezione retto-anale o rettorettale, il perineo discendente, l’entero o sigmoidocele, il cistocele ed il rettocele. Anche un precedente intervento chirurgico sul retto o sul colon potrebbe essere implicato nell’insorgenza dell’ODS come parte di una più complessa sindrome da resezione anteriore del retto[3].
La ODS è frequentemente associata ad altri disturbi funzionali che interessano i compartimenti pelvici anteriore e medio, come il prolasso genitale, le disfunzioni sessuali, l’incontinenza o la ritenzione urinaria.
La classificazione della gravità dell’ODS è molto importante al fine di quantificare gli effetti di questa malattia ed anche valutare l’esito di qualsiasi trattamento, in particolare nell’ambito di trial controllati. Ad oggi esiste sistema di scoring specifico per l’ODS che è stato validato statisticamente e viene utilizzato nella pratica clinica per la maggior parte dei pazienti affetti da ODS e sottoposti a trattamento[4].
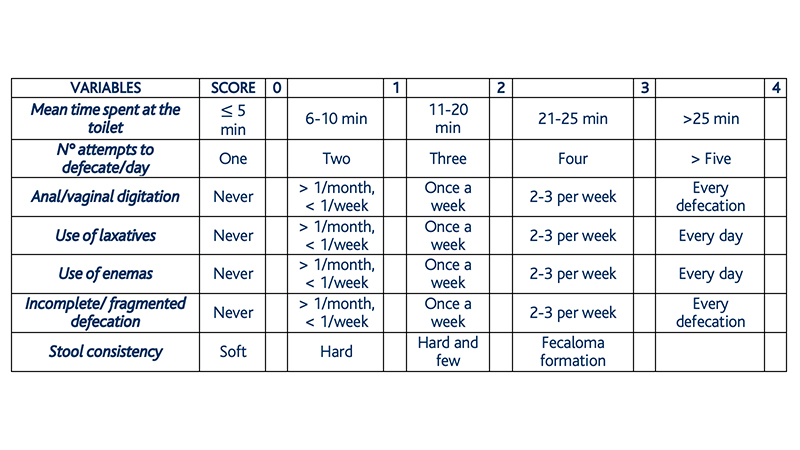
Tabella 1. ODS score
La diversa anatomia del tratto genitale e lo stress delle strutture pelviche durante le gravidanze potrebbero essere implicati nella maggiore prevalenza di questa sindrome nel sesso femminile. I disturbi pelvici funzionali spesso coinvolgono diversi compartimenti pelvici e per avere una visione di insieme della funzione pelvica, è stato sviluppato e validato un altro questionario e sistema di scoring, il TAPE score (Three Axial Pelvic Evaluation score)[5].
La diagnostica per immagini riveste un ruolo essenziale nella definizione diagnostica e nella scelta terapeutica.
L’esame di prima scelta è la colpodefecografia dinamica associata se necessario alla cistografia e alla enterografia (nel caso si sospetti un cistocele e un enterocele). L’esame si esegue registrando su CD/DVD una vera defecazione dopo aver riempito l’ampolla rettale con una pappa radiopaca della stessa consistenza e temperatura delle feci (ottenuta per esempio bollendo porridge e polvere di solfato di bario) introdotta attraverso lano con un speciale siringone. Lo stesso mezzo di contrasto serve per opacizzare la vagina mentre la vescica può essere riempita con idoneo mdc introdotto attraverso un catetere vescicale e l’intestino tenue bevendo una soluzione baritata ½ ora circa prima dell’esame.
La defeco RMN, suggerita da alcuni autori, ha il vantaggio di non irradiare la paziente e di dare una visione di insieme degli organi pelvici durante la defecazione, ma la posizione distesa assunta dal paziente durante l’esame, non consente una fisiologica defecazione portando a sottostimare alcune anomalie della defecazione come la intusssucezione che, tipicamente, si manifesta al termine dell’atto defecatorio.
Fortunatamente non tutti i pazienti con ODS necessitano di un intervento chirurgico. Diversi farmaci, come lassativi osmotici salini, lattulosio ed agenti irritanti (senna o bisacodile) possono rendere più agevole la defecazione di questi pazienti. Anche altri trattamenti conservativi come l’idrocolonterapia, il lavaggio o l’irrigazione rettale con acqua calda possono migliorare i sintomi nei pazienti non responsivi alla terapia lassativa.
Nei pazienti affetti da ODS dovuta a dissinergia del pavimento pelvico potrebbe essere utile un trattamento riabilitativo consistente in terapia di psicocinesi associata a biofeedback, ginnastica del pavimento pelvico, esercizi di yoga o anche l’iniezione di tossina botulinica nei pazienti refrattari alla terapia conservativa.
Sia in caso di trattamento medico che chirurgico, un supporto psicologico è importante per migliorarne l’esito.
Il trattamento chirurgico è complesso poiché la correzione dell’alterazione anatomica identificata non sempre corrisponde ad un miglioramento del quadro clinico funzionale spesso perché ad essa possono essere associate molteplici alterazioni funzionali non identificate (teoria dell’Iceberg [6]) e c’è anche il rischio di insorgenza di altri disturbi funzionali tra cui dolore, urgenza, incontinenza fecale o stipsi de-novo.
I compartimenti del pavimento pelvico devono essere considerati come un’unità funzionale, poiché condividono muscoli, ligamenti e innervazione. Infatti, l’insorgenza di ODS è frequentemente associata ad altri disturbi funzionali che coinvolgono i comparti pelvici anteriore e medio come il prolasso genitale, disfunzioni sessuali, incontinenza o ritenzione urinaria e che possono essere influenzate da interventi chirurgici sul compartimento posteriore.
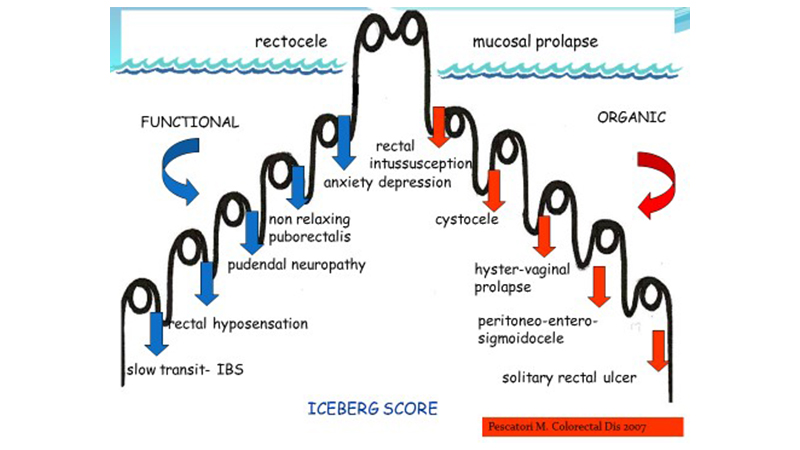
Figura 1. Schema dell’iceberg syndrome per l’ostruita defecazione
TRATTAMENTO CHIRURGICO DELLA OSTRUITA DEFECAZIONE
Le varie tecniche per il trattamento chirurgico della ostruita defecazione sono ben descritte in una recente pubblicazione della Springer (Rectal prolapse, Diagnosis and Clinical Management. Springer 2008. D. F Altomare and F. Pucciani Editors).
L’intussuscezione rettale e il rettocele sono gli scenari più frequentemente riscontrati alla defecografia dinamica nei pazienti con ODS[7].

Figura 2. Ampio rettocele
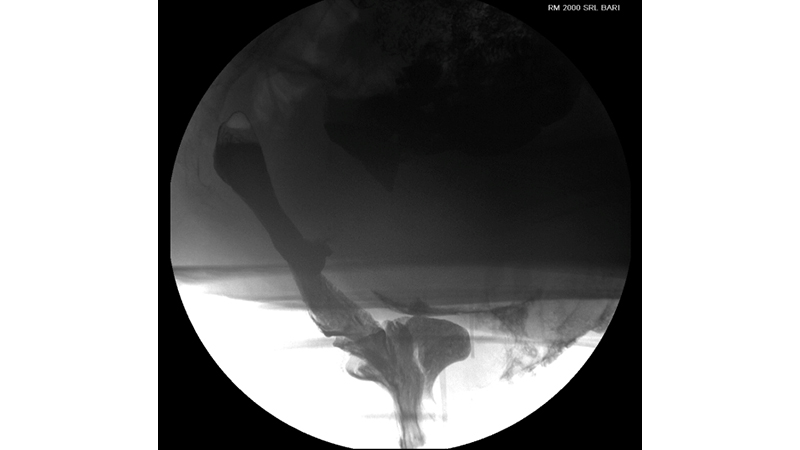
Figura 3. Intussuscezione rettorettale
Entrambi possono essere trattati con chirurgia addominale con tecnica open (eseguendo un’incisione sulla linea mediana o un’incisione di Pfannenstiel), con tecnica laparoscopica, robotica o con approccio perineale/transanale.
A causa della natura benigna della malattia, l’approccio laparoscopico, quando possibile, è oggi preferito poiché vi è una guarigione più rapida senza problemi correlati alle ferite addominali e perché i pazienti riferiscono ridotto dolore postoperatorio e migliori risultati estetici.
Intervento di Ripstein
In questa operazione il retto viene completamente mobilizzato posteriormente fino al coccige, preservando i nervi ipogastrici e i legamenti laterali del retto.
Una volta mobilizzato il retto, una mesh rettangolare di 5 cm viene posizionata anteriormente attorno al retto 5 cm sotto il promontorio sacrale e fissata alla fascia presacrale mediante suture non riassorbibili a 1 cm dalla linea mediana su entrambi i lati.
Questa operazione è stata ormai praticamente abbandonata a causa del rischio di peggioramento della stitichezza, potenziali lesioni del plesso pelvico e complicanze quali occlusioni dell’intestino tenue e crasso, lesioni o fibrosi ureterali, recidiva di prolasso, fistole rettovaginali, stipsi postoperatoria e stenosi del lume rettale[8, 9].
Intervento di Wells
Il retto è completamente mobilizzato secondo la tecnica standard dell’asportazione del mesoretto. La dissezione anteriore viene eseguita lungo la fascia di Denonvilliers o nello spazio rettovaginale e la mesh protesica viene posizionata dietro il retto mobilizzato e ancorata alla fascia presacrale sulla linea mediana con suture non riassorbibili[10, 11]. La protesi viene suturata anche sulle pareti laterali del retto. Alla fine, la protesi avvolge il retto per non più di 270 gradi.
I risultati funzionali mostrano un miglioramento della continenza in più del 50% dei casi, ma nel periodo post-operatorio possono verificarsi difficoltà di evacuazione, in parte dovute ad un’eccessiva mobilizzazione del retto.
Tecnica di Orr-Loygue
La mobilizzazione rettale segue gli stessi passaggi delle procedure Ripstein e Wells, ma la protesi è posizionata in modo diverso. Vengono utilizzate 2 porzioni di protesi separate e suturate lateralmente al retto basso e al promontorio sacrale. La logica è quella di mantenere il retto sospeso (prevenendo il prolasso) senza alcun ostacolo al processo di defecazione.
Operazione di Frykman-Goldberg
- Tecnica di chirurgia open: il retto è completamente mobilizzato posteriormente fino al piano dei muscoli elevatori dell’ano. La dissezione viene eseguita nello spazio presacrale, preservando i nervi. La dissezione continua fino alla prostata negli uomini e fino alla parete posteriore della vagina nelle donne.
Quindi, le pareti laterali del retto mobilizzato vengono fissate al periostio sacrale mediante punti non riassorbibili. Il sigma ridondante viene rimosso e viene eseguita un’anastomosi colorettale manuale o con suturatrice meccanica, latero-terminale o termino-terminale. - Tecnica laparoscopica: l’operazione viene eseguita con la stessa sequenza della tecnica open. Il sigma distale viene interrotto a livello della giunzione retto-sigmoidea con una suturatrice lineare laparoscopica (EndoGIA) ed esteriorizzato attraverso una mini incisione trasversale di Pfannenstiel. Quindi il sigma ridondante viene asportato e viene utilizzata una suturatrice circolare meccanica per l’anastomosi colorettale latero-terminale o termino-terminale.
In questa operazione è sconsigliato l’uso di reti non riassorbibili a causa dell’alto rischio di infezione.
Rettopessi ventrale
Descritta da D’Hoore nel 2004 la rettopessi ventrale laparoscopica (RVL)[12] è una tecnica sicura e affidabile per il trattamento dell’intussuscezione rettale ed ha ottenuto un ampio consenso tra i chirurghi colorettali. La logica di questa operazione è correggere l’intussuscezione rinforzando la parete rettale anteriore per correggere il rettocele e chiudendo lo scavo di Douglas per prevenire l’enterocele.
Dopo l’induzione del pneumoperitoneo, viene creato uno spazio di dissezione sul lato destro del promontorio sacrale; il peritoneo viene inciso fino allo scavo di Douglas risparmiando il nervo ipogastrico e l’uretere destro.
Si apre il peritoneo sulla parete posteriore del setto rettovaginale e si posiziona e si sutura una protesi in polipropilene o una protesi biologica sulla parete anteriore del retto mediante punti in Vycril e sul promontorio sacrale mediante punti non riassorbibili o mediante il dispositivo ProTack™. Il peritoneo e lo scavo Douglas vengono chiusi mediante una sutura con filo V-lock.
Intervento di STARR (Resezione Rettale TransAnale con Stapler)
L’intervento di STARR è un’operazione transanale proposta per trattare l’ODS da prolasso rettale interno[13].
Un dilatatore anale circolare (CAD33) viene introdotto e fissato alla cute perineale. L’apice della parte anteriore del prolasso mucoso viene tirato in basso con 4-6 punti di sutura nel lato anteriore della suturatrice che viene poi attivata, mentre la mucosa del retto posteriore viene allontanata da una sottile valva tra CAD e anale canale. La stessa procedura viene ripetuta per la parte posteriore del prolasso utilizzando una seconda suturatrice.
È stata descritta un’incidenza, anche se bassa, di complicanze maggiori intra-postoperatorie, come perforazioni rettali, ematomi e formazione di fistole rettovaginali[14]. I dati a lungo termine dimostrano potenziali complicazioni come incontinenza fecale, dolore anale persistente e ODS[15].
È stato inoltre sviluppato e proposto un ulteriore approccio transanale (TransSTARR) utilizzando una suturatrice curva (Contour, Ethicon Endosurgery), sebbene la sua diffusione nella comunità colorettale sia ancora limitata.
Negli ultimi anni questi tipi di approccio transanale sono stati progressivamente abbandonati nella maggior parte dei Centri europei a favore della rettopessi ventrale[16].
Delorme interna
La tecnica perineale descritta da Delorme per il trattamento del prolasso anale esterno, può essere modificata per trattare l’intussuscezione interna con l’ausilio di un dilatatore circolare endoanale (CAD). La mucosa prolassata viene dissecata e lo strato muscolare sottostante viene plicato trasversalmente e seguito da una sutura muco-mucosa con punti non riassorbibili. Il vantaggio rispetto all’operazione STARR è che tutta la mucosa prolassata può essere asportata e lo strato muscolare del retto viene risparmiato. Un potenziale svantaggio è il rischio di stenosi anale come avviene in molte anastomosi coloanali [17].
Riparazione del rettocele per via perineale o transvaginale
Nell’approccio perineale l’accesso al setto rettovaginale può essere eseguito mediante una incisione perianale anteriore o più comunemente attraverso una colpotomia posteriore. Nel primo caso il raggiungimento del piano di clivaggio è più indaginoso, la visibilità del campo operatorio minore e la guarigione della ferita perianale spesso problematica, nell’approccio transvaginale l’intervento è tecnicamente più semplice ma il rischio di dispareunia maggiore.
Nell’approccio transvaginale viene eseguita una piccola incisione trasversale subito al di sotto dell’ostio vaginale e la vagina viene incisa sulla linea mediana e aperta lateralmente per esporre la parete rettale anteriore fino all’apice del rettocele. La parete anteriore del retto viene rinforzata dalla plicatura con punti di sutura o dal posizionamento di una protesi.
BIBLIOGRAFIA
- Martelli, H., et al., Mechanisms of idiopathic constipation: outlet obstruction. Gastroenterology, 1978. 75(4): p. 623-31.
- Whitehead, W.E., et al., Functional disorders of the anus and rectum. Gut, 1999. 45 Suppl 2: p. II55-9.
- Dilke, S., et al., Anterior Resection Syndrome and Quality of Life with Long-term Follow up After Rectal Cancer Resection. Dis Colon Rectum, 2021.
- Altomare, D.F., et al., Set-up and statistical validation of a new scoring system for obstructed defaecation syndrome. Colorectal Dis, 2008. 10(1): p. 84-8.
- Altomare, D.F., et al., The Three Axial Perineal Evaluation (TAPE) score: a new scoring system for comprehensive evaluation of pelvic floor function. Colorectal Dis, 2014. 16(6): p. 459-68.
- Podzemny, V., L.C. Pescatori, and M. Pescatori, Management of obstructed defecation. World J Gastroenterol, 2015. 21(4): p. 1053-60.
- Karlbom, U., et al., Defecographic study of rectal evacuation in constipated patients and control subjects. Radiology, 1999. 210(1): p. 103-8.
- Lehur, P.A. and A. Hamy, [Surgical treatment of rectoceles by the perineal-vaginal route: rectal folds, vaginal sacrospinal fixation and posterior perineorrhapy]. J Chir (Paris), 2000. 137(3): p. 165-9.
- Schultz, I., et al., Long-term results and functional outcome after Ripstein rectopexy. Dis Colon Rectum, 2000. 43(1): p. 35-43.
- Mann, C.V. and C. Hoffman, Complete rectal prolapse: the anatomical and functional results of treatment by an extended abdominal rectopexy. Br J Surg, 1988. 75(1): p. 34-7.
- Lucarotti, M.E., C.P. Armstrong, and D.C. Bartolo, Control of presacral bleeding in rectal surgery. Ann R Coll Surg Engl, 1991. 73(5): p. 289-90.
- D’Hoore, A., R. Cadoni, and F. Penninckx, Long-term outcome of laparoscopic ventral rectopexy for total rectal prolapse. Br J Surg, 2004. 91(11): p. 1500-5.
- Jayne, D.G. and P.J. Finan, Stapled transanal rectal resection for obstructed defaecation and evidence-based practice. Br J Surg, 2005. 92(7): p. 793-4.
- Pescatori, M., et al., Rectovaginal fistula after double-stapled transanal rectotomy (STARR) for obstructed defaecation. Int J Colorectal Dis, 2005. 20(1): p. 83-5.
- Gagliardi, G., et al., Results, outcome predictors, and complications after stapled transanal rectal resection for obstructed defecation. Dis Colon Rectum, 2008. 51(2): p. 186-95; discussion 195.
- Kim, M., et al., Current surgical treatment of obstructed defecation among selected European opinion leaders in pelvic floor surgery. Tech Coloproctol, 2016. 20(6): p. 395-399.
- Ohazuruike, N.L., et al., Short-term results after STARR versus internal Delorme for obstructed defecation: a non-randomized prospective study. Updates Surg, 2014. 66(2): p. 151-6.
Approfondimento a cura di:
Il Professor Donato Francesco Altomare ha conseguito la Laurea in Medicina e Chirurgia nel 1979 con 110/110 e lode e la specializzazione in Chirurgia Generale nel 1984 con 70/70 e...
Leggi la Bio


