
INDICE
Epidemiologia
Diffusione
Cancro del retto: diagnostica
Stadiazione del cancro del retto
Cancro del retto: trattamento
IORT (Radioterapia Intraoperatoria)
Il trattamento chirurgico del cancro del retto
Cancro del retto: trattamento postoperatorio
Follow-up
Sindrome da Resezione Anteriore di Retto (LARS)
Bibliografia
EPIDEMIOLOGIA
Le statistiche non sempre separano il cancro del retto dal cancro colorettale.
Negli Stati Uniti i dati epidemiologici mostrano un calo dell’incidenza e della mortalità in senso globale (tab1). Le migliori possibilità di trattamento e la diagnosi in stadi più precoci che in passato spiegano la riduzione della mortalità. Tuttavia si registra un progressivo spostamento verso un’età inferiore ai 65 aa di circa l’1% all’anno ed in particolare del 2% all’anno sotto i 50 anni. [1]
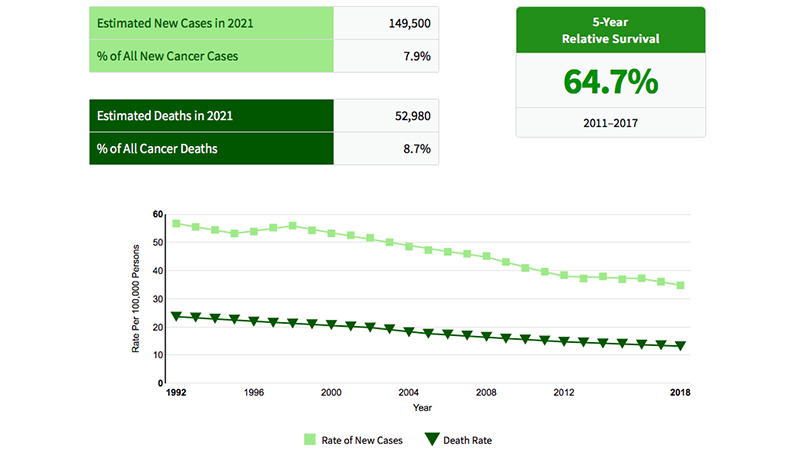
Tabella 1: Andamento dell’incidenza e della mortalità per cancro colorettale negli USA. [2]
Da dati del Ministero della Salute (ISTAT, 2018) in Italia sono stati osservati 19.406 decessi per carcinoma colorettale: 10.581 tra gli uomini e 8.825 tra le donne. La sopravvivenza a 5 anni in Italia è pari al 65%, omogenea tra uomini e donne. Il rischio di ammalarsi di cancro del colon-retto aumenta con l’età. Tali numeri lo pongono al terzo posto per causa di morte per cancro del retto tra gli uomini ed al secondo posto per le donne. [3]
È più diffuso nei paesi occidentali rispetto a quelli orientali, ma la sua incidenza aumenta anche in quei Paesi in cui la dieta progressivamente si sta avvicinando a quella occidentale. È più frequente sopra i 50 anni, ma viene diagnosticato anche i soggetti più giovani. Più del 75% dei soggetti non risulta avere fattori di rischio, così da rendere ancora più indicato uno screening di popolazione.
Fattori di rischio sono ritenuti: una storia familiare di cancro colo-rettale, una dieta a basso contenuto di fibre e ad alto contenuto di grassi, la sedentarietà, il diabete, l’obesità, il fumo, l’alcool, e la radioterapia sull’addome diretta alla cura di altri organi. [4]
E’ stata trovata una correlazione con l’aumento del consumo di carne, più marcatamente per le carni rosse, grasso e proteine animali, zucchero raffinato e basso introito di fibre vegetali. Al contrario, nei paesi in via di sviluppo l’assunzione abbondante di vegetali, soprattutto della famiglia delle crucifere, di proteine vegetali, e di frutta rappresenta un fattore protettivo. [5]
In Europa il consumo di aglio, latte, calcio, e di una dieta ricca di fibre risulta protettivo nell’insorgenza del cancro del retto.[6].
Non tutti gli studi convergono nel ritenere che l’assunzione di methilxantina, contenuta nel tè verde possa dare qualche grado di protezione. [7, 8].
Il cancro del retto può svilupparsi in patologie con infiammazione cronica intestinale con rischio maggiore con l’aumentare della durata della malattia; spesso è preceduto dalla presenza di uno o più polipi di natura benigna o da displasia severa. Queste pre-cancerosi possono essere controllate o trattate (per es.: polipectomia o colectomia) per prevenire l’insorgenza del cancro del retto.
Inoltre lo troviamo in alcune forme a trasmissione genetica come le HNPCC, e le diverse forme di poliposi familiare. La corretta costruzione di un albero genealogico in corso di anamnesi è spesso dirimente ed è la premessa per specifici tests genetici.
Lo screening di popolazione è indicato per l’incidenza elevata del tumore, per il beneficio che se ne trae per la bonifica delle lesioni precancerose, e per il riscontro di lesioni iniziali, ancora asintomatiche. Ciò ha consentito la diminuzione dell’incidenza del tumore e la sua maggiore curabilità.
Anche in Italia la popolazione a cui è indirizzato lo screening è quella che va dai 50 ai 69 anni. L’esame che quasi tutte le regioni stanno utilizzando è la ricerca del sangue occulto fecale per il quale non occorre alcuna preparazione dietetica o intestinale; in caso di positività, si effettua la colonscopia. Quando vengono rinvenuti dei polipi, adenomatosi e/o infiammatori, in base al loro numero e alla bonifica effettuata, si decide il percorso successivo. [9]
DIFFUSIONE
Il tumore del retto si diffonde dalla mucosa fino ad interessare progressivamente la sottomucosa, lo strato muscolare e il grasso mesorettale, per poi infiltrare gli organi vicini, come vagina ed utero nella donna e prostata e vescica nell’uomo. Le vie linfatiche portano ai linfonodi del mesoretto, quindi lungo il decorso dell’arteria emorroidaria superiore, ma anche alle stazioni linfonodali iliache esterne soprattutto se è interessato il retto distale.
E’ attraverso il sistema portale che diffonde per via ematica; il fegato pertanto, essendo il primo filtro, è l’organo più colpito. Nei casi di localizzazione al retto distale le cellule neoplastiche possono essere portate ai vasi iliaci, con localizzazione metastatica in vari organi come polmone, ossa e cervello.
CANCRO DEL RETTO: DIAGNOSTICA
La diagnosi del cancro del retto può essere effettuata in pazienti asintomatici attraverso gli screening di popolazione o in seguito alla presenza di sintomi di allarme. Questi ultimi sono per lo più sfumati, non patognomonici.
Il più frequente è il sanguinamento. Questo sintomo purtroppo si presenta molto spesso nella popolazione adulta occidentale; è legato alla diffusione di patologie benigne come le emorroidi, e come tale viene sottovalutato, finché non si giunge al sanguinamento copioso, talvolta fuori dalla defecazione, alla mucorrea, al tenesmo rettale.
Una visita proctologica inizia con una corretta anamnesi sui sintomi e sull’eventuale familiarità. L’esplorazione rettale spesso individua la presenza di una massa nel retto distale, ed una rettoscopia può confermare il sospetto, nonché dare l’esatta localizzazione in termini di distanza dal margine anale, e del margine prossimale, ed indicazioni sulla sede, anteriore o posteriore, e sul grado di sviluppo circonferenziale; dati che serviranno per un progetto terapeutico.
Da qui le indagini per la diagnosi e la stadiazione. La colonscopia è in grado di rilevare la neoplasia, di effettuare le biopsie nonché di escludere altre lesioni del grosso intestino fino al cieco (fig 1).
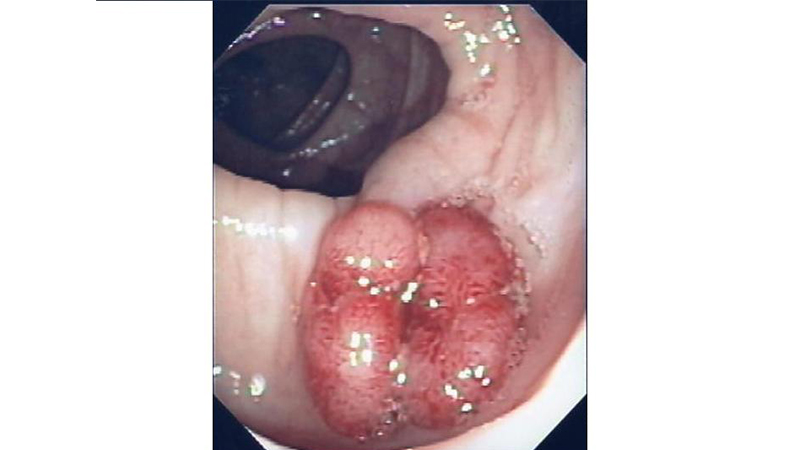
Figura 1: Cancro del retto in visione in corso di colonscopia
Macroscopicamente il il cancro del retto può essere: vegetante, infiltrante, escavato, ulcerato, misto.
STADIAZIONE DEL CANCRO DEL RETTO
La forma istologica più frequente è l’adenocarcinoma; se ne valuta il grado di infiltrazione della parete rettale (T), e l’aggressività è valutabile in tre stadi classificati in base al grado di differenziazione cellulare ed al numero di figure mitotiche: G1 (ben differenziato), G2 (moderatamente differenziato), G3 (scarsamente differenziato). Per la stadiazione si seguono le indicazioni dell’American Joint Conmettee on Cancer (AJCC) [10]) (tab 2).

Tabella 2: Classificazione per TNM e stadio sec AJCC. [10]
Il programma terapeutico potrà essere proposto dopo una completa stadiazione per la quale trovano indicazione alcuni esami: RMN, ecografia transrettale, Tc toraco-addominale, la PET-Tc.
La Risonanza magnetica (RM) pelvica (fig 2) è in grado di ben definire il grado di interessamento del mesoretto, la presenza di linfonodi e il margine circonferenziale (CRM); questi sono fattori che determinano lo stadio locale (T e N) e forniscono informazioni essenziali anche per le decisioni terapeutiche e per la prognosi. [11]
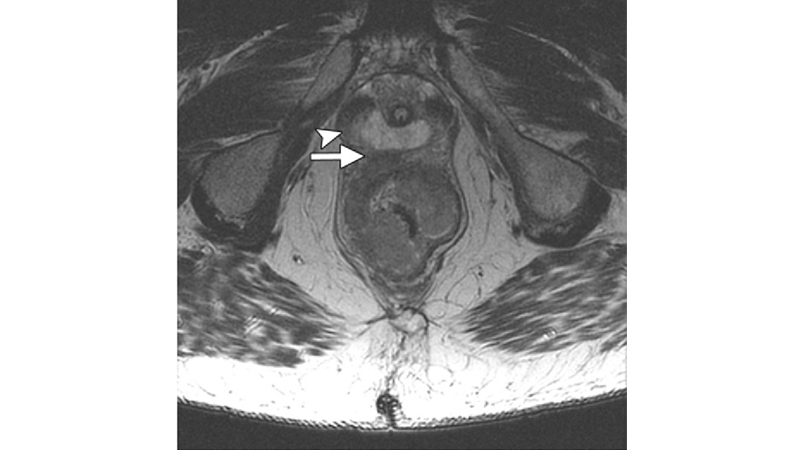
Figura 2: L’immagine della Risonanza magnetica rivela l’invasione della fascia prostatica (T4).
In particolare la misurazione della distanza del tumore dal CRM si è dimostrata uno dei più importanti fattori prognostici indipendenti. [12]
Nello studio Mercury i risultati dopo follow-up a 5 anni dimostravano che la sopravvivenza nei pazienti era del 62.2% contro il 42.2% laddove il CRM era coinvolto. Statisticamente significative erano pure le differenze dei tassi di recidiva locale e della sopravvivenza libera da malattia. [13]
L’ecografia transanale (ERUS) (fig 3, 4) ha il vantaggio della praticità e del basso costo e alcuni studi ne danno la sovrapponibilità di risultati con la RM per T ed N. È dimostrato essere un esame più accurato della RM nella stadiazione delle forme iniziali, come i T1 ed i polipi cancerizzati. Risulta, tuttavia, essere operatore-dipendente. [14]
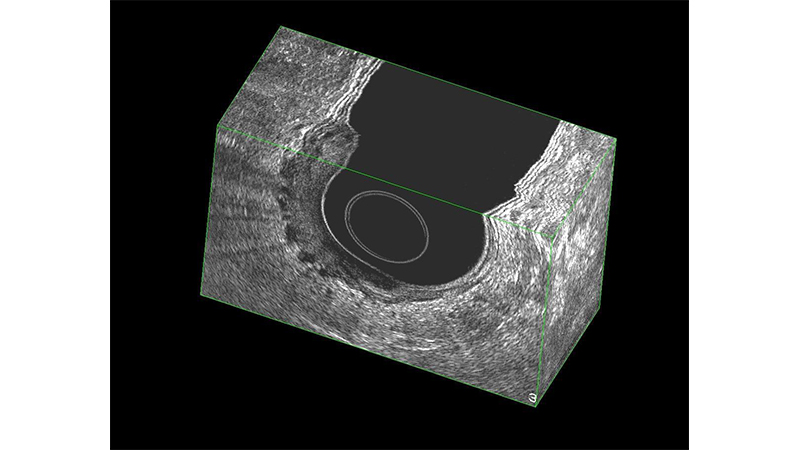
Figura 3: L’ecografia in sezione 3D dimostra il superamento della sottomucosa (Sm-s).
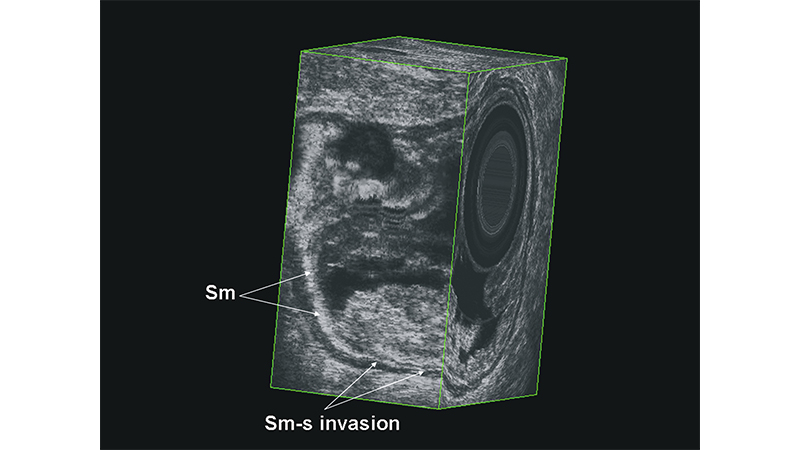
Figura 4: L’ecografia in sezione 3D dimostra l’infiltrazione iniziale del grasso del mesocolon (T3).
Resta ancora non soddisfacente l’accuratezza della ristadiazione dopo trattamenti neoadiuvanti. Da una review risulterebbe un’elevata percentuale di understaging ed overstaging, senza grandi differenze tra ERUS e RM (tab 3). [15]

Tabella 3: grado di accuratezza nella ristadiazione con RM ed ERUS [15]
Nuovi lavori hanno confermato i dati esposti: l’ERUS risulta accurata nella ridefinizione del T nel 61.7% contro il 68% della RM. L’overstaging si ritiene sia legato alla difficoltà di distinguere l’area cicatriziale dal tumore e l’understaging per la frammentazione dello stesso. Per la valutazione linfonodale ERUS da un’accuratezza del 72.3% mentre la RM lo è nel 63.8%. [16]
La TC, ha lo scopo di rilevare metastasi a distanza per formulare un corretto piano terapeutico.
La PET-TC, infine, chiarisce meglio le aree sospette alla TC come possibili metastasi. Anche il livello metabolico delle aree inquisite fornisce un indice di attività della malattia. Si sfrutta tale principio anche per valutare la risposta alla CT o alla RT-CT.
Si è nettamente ridotta l’indicazione all’rx clisma opaco rispetto alla colonscopia che è in grado, non solo di evidenziare le lesioni, ma di effettuarne i prelievi istologici o, in casi specifici, l’asportazione della neoplasia.
Non esistono marcatori sierici specifici per il cancro del retto, marcatori che rientrano più in generale nella diagnostica per gli adenocarcinomi del grosso intestino. Il livello di CEA è più utile quando è elevato prima dell’intervento e si normalizza dopo la resezione del tumore. In tale caso una successiva elevazione del suo livello sierico suggerisce una recidiva o una malattia metastatica.
È a questo punto che il team multisciplinare (MDT), che si occupa del paziente, discute delle possibili strategie terapeutiche.
CANCRO DEL RETTO: TRATTAMENTO
Il trattamento basilare è quello chirurgico (fig 5); la recidiva dipende dallo stadio TNM della neoplasia.
Il primo stadio può essere esclusivamente chirurgico, mentre per quelli più avanzati si opta per i trattamenti neoadiuvanti o adiuvanti.
Il chirurgo è considerato una variabile indipendente nell’ottenimento della radicalità, nel salvataggio degli sfinteri, nella morbilità e nella mortalità post-operatoria.
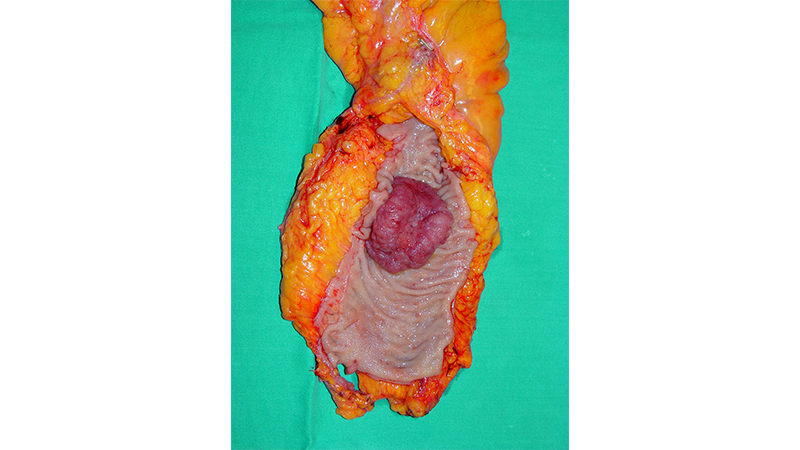
Figura 5: Asportazione chirurgica del retto con la neoplasia.
Le ultime linee-guida dell’NCCN rapportano sia l’approccio terapeutico medico che chirurgico allo stadio della neoplasia. [17]
Trattamento Neoadiuvante: si intende il trattamento effettuato prima della chirurgia. Non è indicato nei tumori siti a monte dei 12 cm dal margine anale, sopra la riflessione peritoneale. È indicato negli stadi II-IV.
Esso ha l’obiettivo di ridurre il volume e se possibile lo stadio della malattia per permettere una migliore radicalizzazione chirurgica. Infatti, in molti casi porta a modificare il programma chirurgico iniziale a favore di un salvataggio degli sfinteri anali o di un salvataggio d’organo, quest’ultimo in caso di scomparsa clinica o, meglio, patologica, della neoplasia.
Vi sono molte tecniche sia radio che chemioterapiche che offrono risultati considerevoli, fino alla scomparsa della neoplasia. La prima divisione è tra short term, somministrata in 5 giorni, e long term con un frazionamento che dura alcune settimane. Il chemioterapico associato ha la funzione di aumentare l’efficacia della RT; il più utilizzato è la Capecitabina, sebbene altre molecole siano in uso in molti protocolli di studio per potenziare questo effetto senza aumentare la tossicità.
Possibili complicanze sono alterazioni della funzione intestinale per enterite attinica; per le donne la stenosi vaginale, ed il rischio di infertilità; mentre negli uomini possono verificarsi problemi erettili e rischio di infertilità. I pazienti vanno informati per la possibilità di utilizzo di una banca dello sperma o degli ovociti.
La Rt in genere ed ancor più se combinata alla brachiterapia, per il cancro del retto causa un danno sfinteriale e della continenza. [18]
Il tempo di attesa tra la fine della terapia neoadiuvante e il trattamento chirurgico risulta cruciale ed ancora oggetto di discussione; si è passati infatti dalle 4 alle 12 settimane ed oltre; si è così ottenuto un progressivo aumento dei casi di riduzione del volume o dello stadio, fino alla scomparsa della neoplasia in più del 20% dei pazienti.
L’aumento dell’intervallo senza alcuna terapia può aumentare, tuttavia, il rischio di metastasi a distanza non evidenziabili alla stadiazione iniziale. Tuttavia lo studio GRECCAR, pur confermando l’importante risposta da retrostadiazione locale, non ha dimostrato esserci alcuna variazione nelle recidive locali, nella sopravvivenza libera da malattia e nella sopravvivenza globale. [19]
È da rilevare che dopo radio-chemioterapia neoadiuvante si ottiene un miglioramento del tasso di recidive locali, ma non della sopravvivenza globale. [20]
Molti argomenti restano sul tavolo della discussione:
- Come definire la scomparsa del cancro del retto, in modo clinico o dopo escissione locale della cicatrice residua? I protocolli di studio più attuali prevedono un’escissione locale con relativo esame istologico e valutazione del grado di regressione (Tumor regression rate, sec Mandard). [21]
- È possibile solo osservare quei pazienti che hanno avuto una scomparsa del tumore? [22-24]
Il numero di recidive locali risulta variabile nei diversi lavori presentati, ma risulta anche che l’intervento di “salvataggio” permette un’alta percentuale di conservazione degli sfinteri e un’ottima sopravvivenza a 5 anni (tab 4).
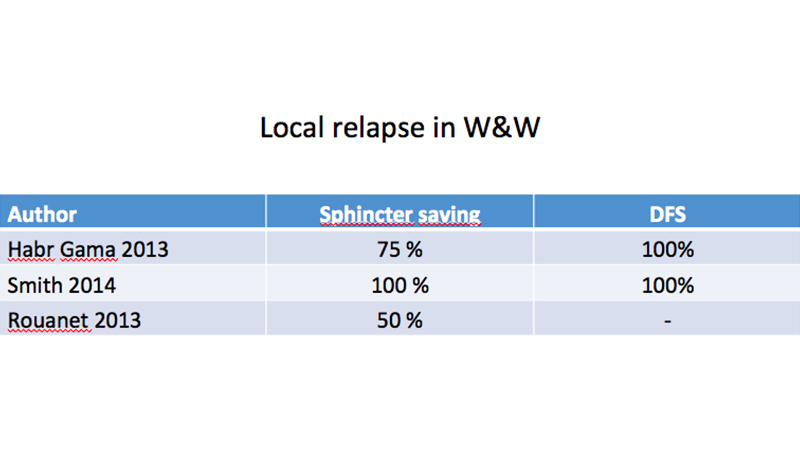
Laddove è stata necessaria una chirurgia successiva di “salvataggio” dopo recidiva locale, si è registrato un maggiore numero di deiscenze anastomotiche senza altri problemi generali nel periodo postoperatorio [25], né nel follow up. [26-28]
Tabella 4: Possibilità di trattamenti conservativi in caso di recidiva locale dopo “Watch and Wait” (W&W);
secondo alcuni AA la percentuale è molto alta e la sopravvivenza libera da malattia a 5 aa (DFS) è ancora del 100%.
IORT (RADIOTERAPIA INTRAOPERATORIA)
Viene utilizzata per i casi di recidiva locale o per i cancri localmente avanzati. È considerata uno strumento aggiuntivo ai trattamenti già descritti in breve.
Le casistiche eterogenee non danno certezza di un beneficio tale da rendere routinaria questa terapia. Da una recente metanalisi, tuttavia, risulta ridurre le recidive locali con una morbilità aggiuntiva assente. La sopravvivenza globale non viene tuttavia migliorata. [43]
IL TRATTAMENTO CHIRURGICO DEL CANCRO DEL RETTO
La chirurgia è il trattamento fondamentale del cancro rettale.
C’è un relativo accordo tra le linee-guida dell’ASCRC, della SICCR, della NICE. [29,30]
Se si è in presenza di un polipo peduncolato già a rischio degenerazione o macroscopicamente degenerato, con una cromoendoscopia favorevole (pattern II-IV), è possibile supporre una scarsa invasione e un basso rischio di linfoadenopatie mesorettali; pertanto è accettabile una resezione endoscopica. [31]
Le lesioni macroscopicamente depresse, ulcerate sono associate a invasione più profonda della parete rettale, e pertanto non vanno rimosse endoscopicamente, ancor meno se si è di fronte ad un pattern V. [32,33]
L’escissione locale curativa utilizzando la microchirurgia transanale endoscopica (TEM), e più recentemente la TAMIS, è un trattamento appropriato per pazienti selezionati con tumori T1 a basso rischio; essa va condotta sempre a tutto spessore. Se l’esame istologico definitivo dimostra uno stadio più avanzato, si ricorrerà, come anticipato in precedenza, ad una escissione totale del mesoretto, tranne che le condizioni generali del paziente non pongano controindicazioni all’intervento.
È da sottolineare che una chirurgia di completamento, ovvero una chirurgia resettiva dopo escissione locale effettuata in TAMIS, comporta un maggior numero di resezioni per via addomino-perineale, sebbene vi siano pari morbilità e simili risultati oncologici. [34]
La chirurgia resettiva prevede l’asportazione completa del mesoretto, una distanza di 2 cm dal margine distale della neoplasia e l’asportazione della catena linfonodale fino alla radice dell’arteria mesenterica inferiore.
Vi è ancora discussione sull’opportunità di uno svuotamento linfonodale laterale pelvico, gravato da tempi chirurgici più lunghi, maggiore morbilità e con un guadagno debole sul tasso delle recidive locali e della sopravvivenza. [35,36]
L’asportazione anche del blocco sfinteriale, ovvero la resezione per via addomino-perineale, è indicata nei pazienti con interessamento sfinteriale. Una maggiore radicalità oncologica è stata dimostrata con la resezione extraelevatore, spesso chiamata resezione cilindrica, che riducendo il rischio di non essere sufficientemente distanti dal margine circonferenziale abbassa il tasso di recidiva locale. Tale tecnica aumenta, tuttavia, le difficoltà di chiusura della ferita perineale. [37]
L’approccio laparoscopico è indicato nei centri con esperienza poiché si è sempre più dimostrato di pari efficacia oncologica e con alcuni vantaggi sulla chirurgia open. [38]
Infatti, uno studio di confronto tra chirurgia laparoscopica e chirurgia open, entrambe dopo radioterapia, non ha dimostrato a 10 anni di distanza alcuna differenza significativa sulla sopravvivenza globale, sul periodo libero da malattia e sul tasso di recidiva locale. [39]
Alcune metanalisi mettono tuttavia in guardia sulla maggiore incompletezza del margine circonferenziale e dell’escissione mesorettale rilevate in laparoscopia rispetto alla chirurgia open [39] per cui risulta fondamentale la qualità dell’operatore.
Il confronto della chirurgia robotica con quella laparoscopica ha dimostrato una riduzione delle conversioni ed una ridotta incidenza di ritenzione urinaria postoperatoria; ma il tempo chirurgico è più lungo ed i risultati oncologici e funzionali a lungo termine sono sovrapponibili; la conclusione degli AA è che la chirurgia robotica non offre vantaggi rispetto a quella laparoscopica. [41,42]
CANCRO DEL RETTO: TRATTAMENTO POSTOPERATORIO
Non vi è chiarezza sulla strategia da adottare in caso di radicalità chirurgica; infatti non è stato dimostrato un beneficio dal trattamento CT adiuvante in tutti i gruppi di pazienti.
Questo viene riservato ai pazienti ad alto rischio per sottogruppi istologici e per particolari fattori prognostici rilevati all’immunoistochimica, o quando la chirurgia non riesce ad essere radicale, o non è stato possibile effettuare un trattamento neoadiuvante; e quando, infine, si è in presenza di metastasi sincrone o metacrone.
FOLLOW-UP
Le recidive da cancro del retto, locali e a distanza, variano dal 30 al 50%. [44]
Dopo l’introduzione di tecniche più radicali, coma la TME ed i trattamenti neoadiuvanti, le recidive locali si sono ridotte al 6%; le ritroviamo più frequentemente nell’area anastomotica e più spesso a crescita extraluminale. [45]
Molte recidive possono trovare beneficio da un ritrattamento, radio e chemioterapico, e chirurgico, con possibilità di cura locale fino al 25% dei casi. [46]
Gli esami di controllo e gli intervalli utilizzati sono diversi nelle linee guida delle Società scientifiche; CEA, Endoscopia, Eco addome, TC toracica ed addominale, PET-TC sono gli esami maggiormente in grado di rilevare recidive locali ed a distanza. [47-51]
Molti i lavori pubblicati sull’opportunità di un follow-up intensivo verso uno meno aggressivo: in almeno due lavori prospettici e randomizzati, pur rilevando un maggior numero di recidive trattabili, nel gruppo a follow-up stretto non si è registrato alcun miglioramento della sopravvivenza a 5 anni rispetto al gruppo con follow-up meno intensivo. [52,53]
L’NCCN nell’edizione 2021 propone esami e intervalli differenti a seconda dello stadio di malattia. [54]
L’argomento, tuttavia, rimane nelle mani degli specialisti, con decisioni personalizzate meglio se prese in team, e pertanto non approfondito in questa sede.
SINDROME DA RESEZIONE ANTERIORE DI RETTO (LARS)
Nelle resezioni anteriori di retto si confeziona un’ileostomia temporanea, meno frequentemente una colostomia, allo scopo di ridurre gli effetti negativi di una possibile deiscenza anastomotica.
Nei pazienti sottoposti a resezione anteriore del retto è stata descritta una sindrome caratterizzata da urgenza defecatoria, difficoltà di svuotamento, difficoltà a discriminare i gas ed incontinenza fecale (LARS), di difficile trattamento. [55]
Il rischio di sviluppare una LARS è maggiore in caso di derivazione ileale prolungata. Da qui l’opportunità di chiudere precocemente lo stoma per ridurre il rischio di LARS e la sua gravità. [56].
La qualità della vita è molto alterata per le limitazioni sociali che tale sindrome comporta, per cui è stato costruito uno score specifico (Tab 5) che permette di valutare la gravità del quadro e le possibili modifiche prodotte dal trattamento. [57]

Tabella 5: LARS Score: 0-20 normalità; 21-29 moderata; 30-42 grave. [57]
Il trattamento della LARS è spesso deludente per il paziente ed il curante.
In tab 6 si sintetizza il percorso che è stato consigliato in una recente linea-guida. [58]
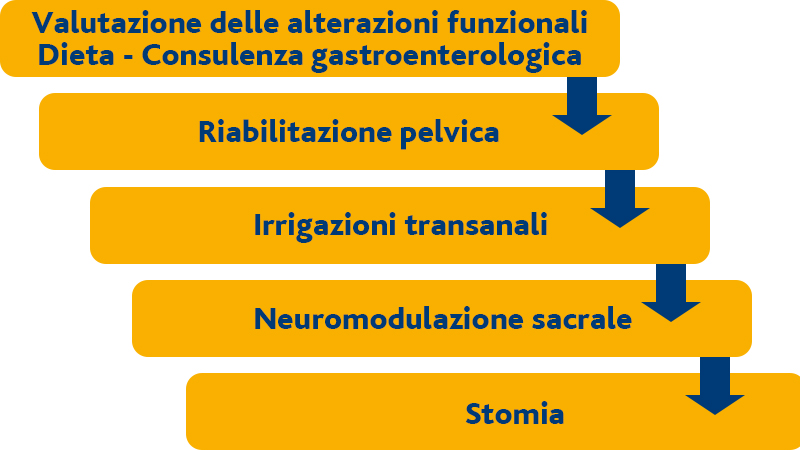
Tabella 6: progressione di intervento nel trattamento della LARS [58].
BIBLIOGRAFIA
- Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics, 2020. CA Cancer J Clin 2020;70(3):145-164.
- https://seer.cancer.gov/statfacts/html/colorect.html
- https://www.salute.gov.it/portale/salute/p1_5.jsp?id=184&area=Tumori
- Deng, Y. Rectal Cancer in Asian vs. Western Countries: Why the Variation in Incidence?. Treat. Options in Oncol.2017;18,64.
- Aleksandrova K, Pischon T, Jenab M et al. Combined impact of healthy lifestyle factors on colorectal cancer: a large European cohort study. BMC Med 2014;12:168.
- Murphy N, Norat T, Ferrari P et al. Dietary fibre intake and risks of cancers of the colon and rectum in the European prospective investigation into cancer and nutrition (EPIC). PLoS One 2012;7: e39361.
- Ming-zhi Zhu, Dan-min Lu, Jian Ouyang, et Al. Tea consumption and colorectal cancer risk: a meta-analysis of prospective cohort studies. Eur J Nutrition 2020;59:3603–3615.
- Stephanie L. Schmit, Hedy S. Rennert, Gad Rennert, Stephen B. Gruber. Coffee Consumption and the Risk of Colorectal Cancer. Cancer Epidemiol Biomarkers Prev 2016;25(4): 634–639.
- American Joint Committee on Cancer (AJCC) TNM Staging System for Rectal Cancer 8th ed., 2017.
- Beets-Tan RG, Lambregts DM, Maas M et al. Magnetic resonance imaging for clinical management of rectal cancer: updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol 2018;28:1465–1475.
- Zhang G, Cai YZ, Xu GH. Diagnostic accuracy of MRI for assessment of T category and circumferential resection margin involvement in patients with rectal cancer: a meta-analysis. Dis Colon Rectum 2016;59:789–799.
- Taylor FG, Quirke P, Heald RJ et al. . Preoperative magnetic resonance imaging assessment of circumferential resection margin predicts disease-free survival and local recurrence: 5-year follow-up results of the MERCURY study. J Clin Oncol 2014;32:34–43.
- Bipat S, Glas AS, Slors FJM et al. . Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging—a meta-analysis. Radiology 2004;232:773–783.
- Memon S, et al. Systematic review and meta-analysis of the accuracy of MRI and endorectal ultrasound in the restaging and response assessment of rectal cancer following neoadjuvant therapy. Colorectal Dis 2015;17(9):748-61.
- Cote A, Florin FG, Mois E, Elisei R, Badea R, Mare C, Hajjar NA, Iancu C, Lebovici A The accuracy of endorectal ultrasonography and high-resolution magnetic resonance imaging for restaging rectal cancer after neoadjuvant chemoradiotherapy. Ann Ital Chir 2018;89:168-176.
- https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf
- Møller Faaborg Pia, Haas S, Liao D. et Al. Long‐term anorectal function in rectal cancer patients treated with chemoradiotherapy and endorectal brachytherapy. Colorectal Dis 2021; https://doi.org/10.1111/codi.15692)
- Lefèvre JH, Mineur L, Cachanado M, Denost Q, Rouanet P, et al; The French Research Group of Rectal Cancer Surgery (GRECCAR). Does A Longer Waiting Period After Neoadjuvant Radio-chemotherapy Improve the Oncological Prognosis of Rectal Cancer?: Three Years’ Follow-up Results of the Greccar-6 Randomized Multicenter Trial. Ann Surg 2019 Nov;270(5):747-754.)
- McCarthy K, Pearson K, Fulton R, Hewitt J. Pre-operative chemoradiation for non-metastatic locally advanced rectal cancer. Cochrane Database Syst Rev 2012;12:CD008368.
- Mandard AN, Dalibar DF, Mandard JC. Pathological assessment of tumour regression after preoperative chemoradiotherapy of oesophageal carcinoma. Clinicopathologic correlations. Cancer 1994;73:2680–2686.
- Habr-Gama A, Sabbaga J, Gama-Rodrigues J, São Julião GP, Proscurshim I, Bailão Aguilar P, Nadalin W, Perez RO.Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer: are we getting closer to anal cancer management? Dis Colon Rectum. 2013 Oct;56(10):1109-17.
- Smith FM, Winter D. Watch and wait for rectal cancer: where are we really at? Colorectal Dis 2014;16(5):332-4.
- Rouanet P, Mourregot Anne, Azar CC, Carrere S, et Al Transanal endoscopic proctectomy: an innovative procedure for difficult resection of rectal tumors in men with narrow pelvis. Dis Colon Rectum 2013;56(4):408-15.
- Levic K, Bulut O, Hesselfeldt P, Bülow S.The outcome of rectal cancer after early salvage TME following TEM compared with primary TME: a case-matched study. Tech Coloproctol. 2013;17(4):397-403.
- Hahnloser D, Wolff BG, Larson DW, Ping J, Nivatvongs S. Immediate radical resection after local excision of rectal cancer: an oncologic compromise? Dis Colon Rectum 2005;48(3):429-37.
- Bujko K, Richter P, Kołodziejczyk M, Nowacki MP, Kulig J, Popiela T, Gach T, Oledzki J, Sopyło R, Meissner W, Wierzbicki R, Polkowski W, Kowalska T, Stryczyńska G, Paprota K; Polish Colorectal Study Group. Preoperative radiotherapy and local excision of rectal cancer with immediate radical re-operation for poor responders. Radiother Oncol 2009;92(2):195-201.
- Gagliardi G, Newton TR, Bailey HR. Local excision of rectal cancer followed by radical surgery because of poor prognostic features does not compromise the long term oncologic outcome. Colorectal Dis 2013;15(11):e659-64.
- Luzietti E., Pellino G, Nikolaou S, Qiu S, Mills S. Warren O, Tekkis P, Kontovounisios C. Comparison of guidelines for the management of rectal cancer. BJS Open. 2018; 2(6): 433–451.
- Guidelines Development Committee; Special Issue: Association of Coloproctology of Great Britain & Ireland (ACPGBI): Guidelines for the Management of Cancer of the Colon, Rectum and Anus Colorect Dis 2017;19:S1:1-97.
- Bianco F, Arezzo A, Agresta F. et al.Practice parameters for early colon cancer management: Italian Society of Colorectal Surgery (Società Italiana di Chirurgia Colo-Rettale; SICCR) guidelines. Tech Coloproctol 2015;19,577–585.
- Kudo S, Rubio CA, Teixeira CR, Kashida H, Kogure E. Pit pattern in colorectal neoplasia: endoscopic magnifying view. Endoscopy 2001;33:3.
- Arezzo, A., Bianco, F., Agresta, F. et al. Practice parameters for early rectal cancer management: Italian Society of Colorectal Surgery (Società Italiana di Chirurgia Colo-Rettale; SICCR) guidelines. Tech Coloproctol 2015;19, 587–593.
- Serra-Aracil X, Saldaña AG, Mora-Lopez L, et Al Completion Surgery in Unfavorable Rectal Cancer after Transanal Endoscopic Microsurgery: Does It Achieve Satisfactory Sphincter Preservation, Quality of Total Mesorectal Excision Specimen, and Long-term Oncological Outcomes? Dis Colon Rectum 23 apr 2021,18:24.
- Malakorn S, Yang Y, Bednarski BK, Kaur H, You YN, Holliday EB, Dasari A, Skibber JM, Rodriguez-Bigas MA, Chang GJ. Who Should Get Lateral Pelvic Lymph Node Dissection After Neoadjuvant Chemoradiation? Dis Colon Rectum 2019;62(10):1158-1166.
- Christou N, Meyer J, Toso C, Ris F, Buchs NC. Lateral lymph node dissection for low rectal cancer: Is it necessary? World J Gastroenterol. 2019;25(31):4294-4299.
- Holm T, Ljung A, H€aggmark T et al. Extended abdominoperineal resection with gluteus maximus flap reconstruction of the pelvic floor for rectal cancer. Br J Surg 2007;94:232–238.
- Nussbaum DP, Speicher PJ, Ganapathi AM, et Al. Laparoscopic versus open low anterior resection for rectal cancer: results from the national cancer data base J Gastrointest Surg. 2015;19(1):124-31.
- Park J, et al Open versus laparoscopic surgery for mid or low rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): 10-year follow-up of an open-label, non-inferiority, randomised controlled trial. Lancet Gastroenterol Hepatol. 2021; doi:10.1016/S2468-1253(21)00094-7.
- Zhao D, Li Y, Wang S, Huang Z. Laparoscopic versus open surgery for rectal cancer: a meta-analysis of 3-year follow-up outcomes. Int J Colorectal Dis 2016;31:805-811.
- Li X, Wang T, Yao L, et al. The safety and effectiveness of robot- assisted versus laparoscopic TME in patients with rectal cancer: A meta- analysis and systematic review. Medicine (Baltimore) 2017;96: p e7585.
- María Pilar Del Gutiérrez Delgado, Santiago Mera Velasco, et Al. Outcomes of robotic-assisted vs conventional laparoscopic surgery among patients undergoing resection for rectal cancer: an observational single hospital study of 300 cases. J Robot Surg 2021 Mar 20. doi: 10.1007/s11701-021-01227-2.
- Matthew R. Fahy, Michael E. Kelly, Megan Power‐Foley, Timothy S. Nugent, Conor J. Shields, Des C. Winter The role of intra‐operative radiotherapy in advanced rectal cancer: a meta‐ Colorectal Dis 2021;00:1-9.
- Anthony T, Simmang C, Hyman N et al. Practice Parameters for the Surveillance and Follow-Up of Patients With Colon and Rectal Cancer. Dis Colon Rectum 2004;47:807–817.
- Meyerhardt JA, Mayer RJ. Follow-up strategies after curative resection of colorectal cancer. Seminars in Oncol 2003;30:349–360.
- Infantino A, Lauretta A. Follow-Up Strategy of the Primary and Early Diagnosis. In “Multimodal Treatment of Recurrent Pelvic Colorectal Cancer” Editors: Giovanni Romano, Springer Ed 2016; pagg 1-13.
- Meyerhardt JA, Mangu PB, Flynn PJ et al. Follow-up care, surveillance protocol, and secondary prevention measures for survivor of colonrectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 2013;31:4465–4470.
- Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Ro ̈del C, Cervantes A , Arnold D, on behalf of the ESMO Guidelines Committee* Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2017;28(4): iv22–iv40.
- Association of Coloproctology of Great Britain & Ireland (ACPGBI): Guidelines for the Management of Cancer of the Colon, Rectum and Anus (2017) Colorect Dis 2017;19:S1:1-97.
- NCCN clinical practice guidelines in oncology (NCCN guidelines). Rectal Cancer. http://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf . Accessed February 26, 2015.
- Primrose JN, Perera R, Gray A, et al. Effect of 3 to 5 years of scheduled cea and ct follow-up to detect recurrence of colorectal cancer: The facs randomized clinical trial. JAMA 2014;311:263-270. Available at: http://www.ncbi.nlm.nih.gov/pubmed/24430319.
- Wille-Jorgensen P, Syk I, Smedh K, et al. Effect of More vs Less Frequent Follow-up Testing on Overall and Colorectal Cancer-Specific Mortality in Patients With Stage II or III Colorectal Cancer: The COLOFOL Randomized Clinical Trial. Jama 2018;319:2095-2103.
- https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf.
- Keane C, Wells C, O’Grady G, Bissett IP. Defining low anterior resection syndrome: a systematic review of the literature. Colorec Dis 2017;19:713-722.
- Vogel, N. Reeves, P. J. Tanis, W. A. Bemelman, J. Torkington, R. Hompes & J. A. Cornish. Impact of a defunctioning ileostomy and time to stoma closure on bowel function after low anterior resection for rectal cancer: a systematic review and meta-analysis. Tech Coloproctol 2021, 25: 751–760.
- Ribas Y, Aguilar F, Jovell-Fernández E, Cayetano L, Navarro-Luna A, Muñoz-Duyos A. Clinical application of the LARS score: results from a pilot study. Int J Colorectal Dis 2017;32:409–18.
- Christensen P, Baeten CIM, Espín-Basany E, Martellucci J et al. Management guidelines for low anterior resection syndrome – the MANUEL project. Colorectal Dis 2021;23:461-475.
Approfondimento a cura di:
Il Dr. Aldo Infantino, Medico Chirurgo Specialista in Coloproctologia, ha conseguito la laurea nel 1977 in Medicina e Chirurgia presso l’Università di Padova, ottenendo poi le specializzazioni in Chirurgia Generale...
Leggi la BioIl Dr. Giulio Aniello Santoro ha conseguito la Laurea in Medicina e Chirurgia presso l’Università degli Studi di NAPOLI "Federico II" nel Luglio 1991 e la conseguente specializzazione in Chirurgia...
Leggi la Bio


