
INTRODUZIONE
Il concetto di malattia pilonidale (MP) è stato introdotto per la prima volta nel 1833 da Herbert Mayo, un anatomista e fisiologo britannico, con la definizione di “un sinus contenente follicoli piliferi situati nella regione sacrococcigea di una paziente di sesso femminile” [1].
Tuttavia, i primi report in letteratura risalgono al 1847 ed al 1854 con i lavori di Anderson e Warren [2, 3].
Anderson descrisse il caso di un uomo di 21 anni con una lesione tubercolare sul dorso. Tale lesione fu drenata 3 settimane più tardi con fuoriuscita di “una ragnatela di peli” lunghi circa 5 centimetri. Ne conseguì la rapida guarigione della ferita.
Sette anni dopo Warren pubblicò la prima casistica esistente riportando 3 casi di malattia pilonidale. Tuttavia, solo nel 1880 Hodges conierà il termine malattia pilonidale (dal latino pilus, peli, e nidus, nido; nido di peli).
ANATOMIA
La sede tipica della malattia pilonidale è la regione sacra-coccigea, nel tessuto sottocutaneo della regione, quasi esclusivamente lungo la linea interglutea.
Nel 90% dei casi, la malattia pilonidale ha una progressione di tipo caudo-craniale, pertanto l’orifizio fistoloso più distale si trova, in genere, ad una distanza di almeno 5-8 cm dall’ano. Nei rari casi di localizzazione più caudale, in cui uno degli orifizi fistolosi può trovarsi a 2-3 cm dall’ano, è necessario fare diagnosi differenziale con una eventuale fistola perianale (cripto-ghiandolare) la cui eziopatogenesi e la cui terapia sono totalmente differenti da quella della malattia pilonidale [5].
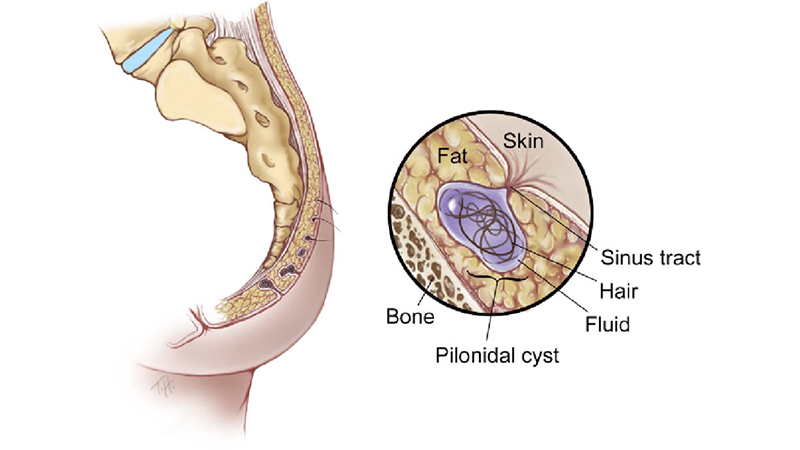
Figura 1. Localizzazione tipica della Malattia Pilonidale
EPIDEMIOLOGIA ED EZIOPATOGENESI
Le malattia pilonidale colpisce principalmente giovani maschi (rapporto maschio/femmina di circa 3:1) di età compresa tra i 15 ed i 30 anni, con una prevalenza che varia tra lo 0,11% e l’8,8% [6].
La malattia pilonidale è rara in soggetti di età minore a 12 anni o maggiore di 40 anni, come anche tra le popolazioni Asiatiche, probabilmente in virtù di un minore quantitativo di peli, mentre è comune tra le popolazioni Indiane, Pakistane, Bengalesi e Singalesi.
Non vi è un’univoca ipotesi eziopatogenica riguardo la malattia pilonidale, ma due teorie sono in primo piano: una congenita, l’altra acquisita.
Le teorie congenite sono le seguenti:
- Le fossette coccigee sarebbero cicatrici embriologiche derivanti da anomalie di formazione del tessuto di rivestimento da difetto di coalescenza a livello del rafe mediano del tessuto sottocutaneo derivato dai foglietti mesoblastici.
Il seno pilonidale deriverebbe da anomalie di chiusura del tubo neurale da fusione del tappo cloacale e del canale neuroenterico al 5° mese di vita fetale. Tali alterazioni comporterebbero la comparsa di un seno comunicante con la sua origine mediante un tramite fistoloso o che abbia perso qualsiasi comunicazione con l’esterno [9, 10].
Questa teoria viene è ancora oggetto di dibattito ed è stata contraddetta da vari argomenti:
-
- il seno pilonidale è in posizione caudale e non lombare;
- non comunica mai con la dura madre;
- il suo rivestimento è in tessuto di granulazione e non di epitelio cuboide;
- non è maggiormente frequente in caso di anomalie come la spina bifida;
- le lesioni cutanee che accompagnano le malformazioni neurologiche distali non hanno simile aspetto clinico;
- la teoria congenita non fornisce spiegazione alla presenza di peli nella cavità pilonidale;
- l’exeresi completa del seno non impedisce la sua recidiva.
- La teoria della ghiandola uropigea, enunciata da Stone nel 1930, e seguita da Fox nel 1933. Secondo questa ipotesi l’inclusione ectodermica avverrebbe intorno al terzo o quarto mese di vita intrauterina al tempo dello sviluppo degli annessi cutanei. I tragitti del sinus potrebbero essere dei residui filogenetici delle ghiandole uropigiali (ghiandole odorifere o ghiandole preistoriche trovate negli uccelli) che crescono verso il basso nell’epitelio fino al tessuto sottocutaneo e successivamente formano un sistema di ramificazione di condotti che sarebbero appunto i sinus [9].
- Durante l’involuzione del residuo della coda umana, l’abbozzo caudale è ancorato alla cute della regione coccigea da robusti fasci fibrosi sulla linea mediana; durante lo sviluppo, per retrogressione dell’abbozzo medesimo, la cute è “attratta” nel sottocute in direzione craniale. La trazione della stessa e delle appendici cutanee nell’area sacro-coccigea porterebbe alla formazione di cisti dermoide-simili nel tessuto sottocutaneo che comunicano con l’esterno tramite tratti rivestiti di epitelio [10].
- La teoria della cisti da sequestro (sostenuta da Bland-Sutton nel 1922) farebbe dipendere la fistola pilonidale dall’inclusione di cute e di annessi presenti sulla linea mediana nel piano sottocutaneo [11].
Tuttavia, si notano delle carenze evidenti in tutte le teorie congenite che non spiegano il motivo della maggiore incidenza nel sesso maschile, della mancata formazione del sinus nella regione cervicale e toracica della colonna vertebrale, della correlazione con attività lavorative e la relativamente tardiva presentazione di un difetto congenito.
Studi successivi sull’eziopatogenesi della patologia sono a favore della teoria acquisita sulla base dell’evidenza che la malattia è sicuramente legata alle caratteristiche ed allo sviluppo dell’apparato pilosebaceo, insorgendo, infatti, in età post-puberale e raramente dopo i 40 anni, soprattutto in soggetti maschi e con apparato pilosebaceo fortemente rappresentato.
In ogni caso, hanno sicuramente un’importanza primaria nella patogenesi l’obesità e la prolungata posizione seduta che causa compressione ed irritazione sulla regione sacrococcigea. Per tale motivo, e per l’estrema frequenza durante la Seconda Guerra Mondiale nei guidatori di jeep, la malattia pilonidale venne definita come “jeep disease” da Buie [12].
Nel 1980, John Bascom ha confutato strenuamente la teoria congenita e dimostrato come la malattia pilonidale sia, in realtà, una condizione del tutto acquisita, pur con fattori favorenti congeniti (quali la conformazione del coccige e l’irsutismo) [13]. Infatti, secondo la teoria di Bascom, la malattia pilonidale origina dai follicoli piliferi del solco intergluteo e il processo di formazione del sinus risulta facilitato dalle particolari conformazioni incavate del solco stesso. Akinci et al. hanno confermato come i pazienti affetti da malattia pilonidale avessero un solco intergluteo più profondo [14].
Altri fattori predisponenti fino ad ora identificati sono l’uso di steroidi (ad es. in caso di asma bronchiale), la familiarità per malattia pilonidale, la partecipazione ad attività con alto coefficiente di impatto coccigeo (ad esempio equitazione, canottaggio, ciclismo), la tendenza a presentare follicoli piliferi o ghiandole sebacee bloccate (acne, foruncoli, cisti sebacee), la tendenza ad altri disordini cutanei (eczema), la debolezza del sistema immunitario e la presenza di cheratina in eccesso nei follicoli piliferi (Figura 2A).
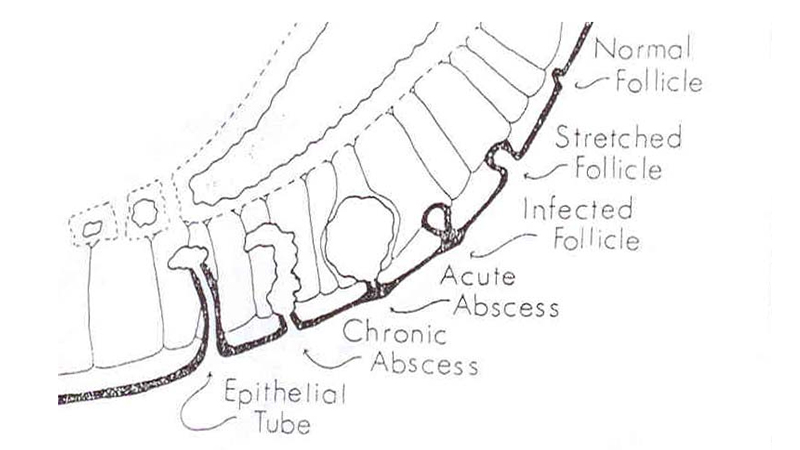
Figura 2A. Eziopatogenesi secondo Bascom
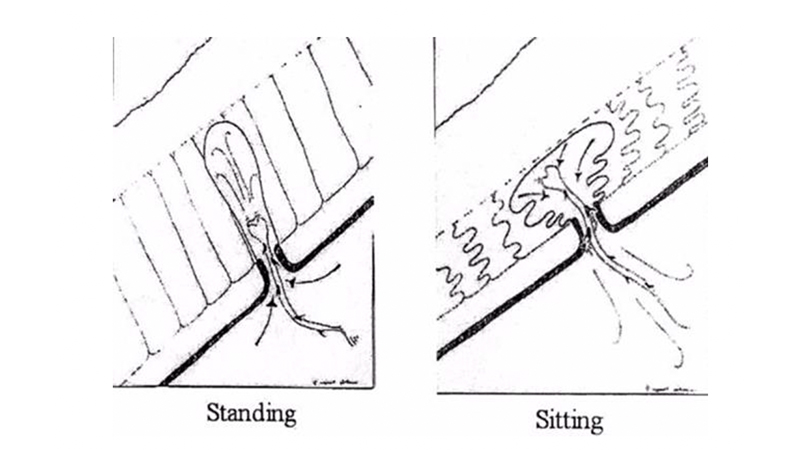
Figura 2B. Azione delle forze dinamiche sul sinus secondo Bascom
La possibilità di recidive dopo chirurgia escissionale e la presenza di lesioni simili descritte negli spazi interdigitali e nella regione periombelicale e del cuoio capelluto rafforzano la teoria acquisita.
Tuttavia, la realtà è verosimilmente mista [14] con una concomitanza delle due teorie.
Alla pubertà, gli ormoni sessuali stimolano i follicoli piliferi e le ghiandole pilosebacee e, di conseguenza, il follicolo pilifero viene disteso da cheratina. Inizialmente la cheratina occlude il follicolo disteso creando una pseudocisti che viene considerata la fase iniziale della malattia pilonidale, clinicamente costituita da una piccola tumefazione poco dolente del solco intergluteo.
Quest’ultima viene spesso incorrettamente definita come una cisti anche se la cavità pilonidale che ne risulta non è esattamente tale considerando la mancanza dello strato epitelizzato; al contrario, il tratto fibroso del sinus può essere epitelizzato.
Queste pseudocisti, sottoposte a microtraumi continui come nella posizione seduta, finiscono con l’andare incontro ad una infiammazione e ad infezione da parte dei batteri cutanei (inizialmente Gram positivi e successivamente anaerobi) con formazione di un ascesso pilonidale (forma acuta).
Se l’ascesso si apre all’esterno, l’infiammazione si risolve e il follicolo si riapre: ciò che resta del follicolo e della cavità micro-ascessuale forma una malattia pilonidale drenante tramite un breve canale che mette in comunicazione la cavità cistica ascessualizzata con l’esterno attraverso uno o più orifizi nel solco intergluteo (forma cronica).
Alcune posizioni, come quella seduta prolungata, facilitano, come detto, il processo di inglobamento, favorito anche da particolari attività lavorative o sportive che espongono a microtraumi la regione sacro-coccigea, in virtù delle forze dinamiche in gioco (Figura 2B).
Karydakis nel 1992 attribuì lo sviluppo della malattia pilonidale a 3 fattori principali, studiati nel suo lavoro comprendente 6000 pazienti.
Le tre variabili erano concorrenti tra di loro (Figure 3, 4) e sono le seguenti:
- “invasore”, “H” (peli liberi, detriti cutanei);
- “forza”, “F” (causa penetrazione, influenzata da fattori secondari come profondità, frizioni e microtraumi del solco intergluteo);
- “vulnerabilità” della cute, “V” (vulnerabilità della cute e dei tessuti locali all’inoculamento di peli nel solco) [15].

Figura 3. Equazione di Karydakis
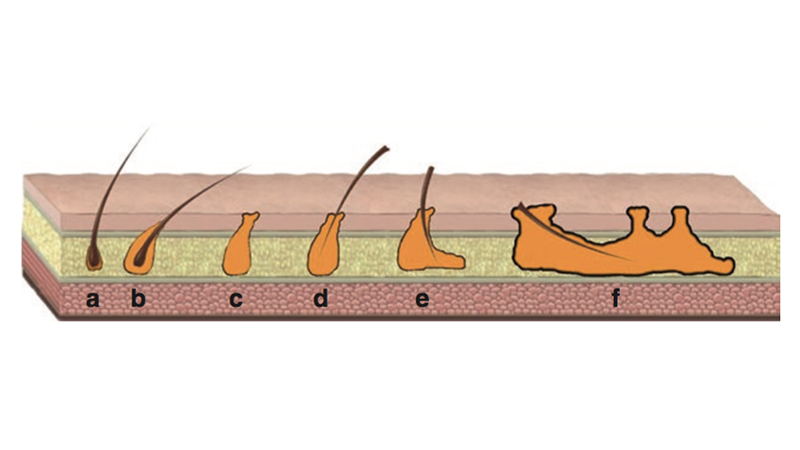
Figura 4. Karydakis, negli studi del 1973, evidenzia che i peli caduti rimangono intrappolati nel tessuto normale e inducono una reazione estranea avversa. Ne risulta un foro secondario alla penetrazione del pelo nel tessuto sottocutaneo e l’entrata di nuovi peli in esso) [16].
CLASSIFICAZIONE E CLINICA
Un sistema di classificazione è stato proposto da Tezel [17] nel 2007, basato sulle teorie eziopatogenetiche di Bascom, secondo cui l’origine del sinus si ritrova nell’epidermide della regione del solco intergluteo esposta a fattori “ambientali”.
Tezel classificò la patologia in cinque tipi:
- Tipo I – orifizio asintomatico senza episodi di ascessi o secrezioni. Non richiede trattamento chirurgico e sono sufficienti alla guarigione una buona igiene e la rimozione dei peli.
- Tipo II – ascesso pilonidale acuto. Il trattamento è generalmente il drenaggio con incisione e non richiede ulteriori procedure.
- Tipo III – orifizio contenuto all’interno dell’area interglutea con episodi di ascesso o secrezione. In questo caso è indicato il trattamento chirurgico.
- Tipo IV – patologia estesa con almeno un orifizio alloggiato al di fuori della zona interglutea. Trattamento chirurgico.
- Tipo V – patologia ricorrente. Il trattamento è chirurgico.
Un altro sistema di staging è stato proposto recentemente da Guner et al [18] che classifica la patologia in base alle caratteristiche morfologiche in 4 stadi:
- Stadio I — unico orifizio lungo la linea mediana, senza estensione laterale.
- Stadio II — più di un orifizio lungo la linea mediana, senza estensione laterale:
- IIa: 2–3 orifizi lungo la linea mediana;
- IIb: >3 orifizi lungo la linea mediana;
- Stadio III — orifizio mediale con estensione laterale in una direzione.
- Stadio IV — orifizio mediale con estensione laterale in entrambe le direzioni
- Stadio R — il suffisso R viene aggiunto in caso di recidiva dopo il trattamento chirurgico.
Numerosi autori ritengono che la stadiazione di Guner et al. sia la più adatta da applicare alla pratica clinica.
Clinicamente, la malattia pilonidale può presentarsi in varie fasi evolutive di lesione:
- la cisti pilonidale si manifesta clinicamente come una piccola tumefazione sottocutanea del solco intergluteo, con o senza secrezione, non dolente;
- l’ascesso pilonidale compare nella fase acuta in cui la tumefazione aumenta di volume, diviene intensamente dolente con arrossamento cutaneo;
- la fistola pilonidale che residua dall’ascesso sia dopo apertura spontanea che dopo incisione chirurgica, con una secrezione siero-purulenta e con dolori intermittenti nella stessa sede. Gli orifizi fistolosi possono essere plurimi e mediali nel solco intergluteo, a laterali rispetto allo stesso, talvolta rinvenibili solo dopo attenta osservazione o depilazione, tipicamente disposti a “corona di rosario”.
La malattia pilonidale può essere anche asintomatica. Infatti, in un recente studio è stato evidenziata una prevalenza di malattia pilonidale silente del 3.7% (16/432) [19]. L’ascesso acuto è spesso il sintomo d’esordio (54% dei 116 pazienti nella casistica di Sondenaa) [20], ma può anche intervenire nel corso dell’evoluzione di una fistola cronica.
La diagnosi di malattia pilonidale è clinica ed è basata su anamnesi ed esame obiettivo (Livello di Evidenza 1; Grado di Raccomandazione C) [21].
Gli esami diagnostici complementari come ecografia endoanale, manometria anorettale, TC e RM sono utili per escludere la presenza di altre malattie colorettali.
L’esame obiettivo mette in evidenza uno o diversi orifizi primari a livello del solco intergluteo sulla linea mediana dai quali fuoriesce pus o siero. Lateralmente, possono essere presenti uno o più orifizi secondari comunicanti con almeno uno degli orifizi mediali. Queste forme croniche evolvono solitamente con degli accessi infiammatori più o meno intensi e con perdite intermittenti. Il sinus contiene peli dispersi, sciolti e liberi, provenienti dalla regione sacro-coccigea o da altre sedi limitrofe e non, insieme a detriti cutanei e tessuto di granulazione. L’infiltrazione cellulare spesso include cellule giganti che aggravano la condizione.
Quando non operata, la malattia può anche rimanere quiescente, ma è frequente la estensione della fistolizzazione in senso craniale o caudale, sia lateralmente verso i glutei. In taluni casi l’estensione distale può raggiungere la regione perianale, creando difficoltà diagnostica con una fistola perianale.
Le complicanze incombono soprattutto a seguito dell’assenza di trattamento e includono la mancata guarigione della ferita e la tendenza alla colonizzazione ricorrente delle fistole da parte di Gram positivi e occasionalmente anaerobi che trovano nel solco intergluteo un ambiente privo di ossigeno favorevole alla loro proliferazione. La prolungata affezione dalla patologia aumenta, inoltre, il rischio di degenerazione carcinomatosa del tratto fistoloso.
Davis et al. nel 1994 documentarono 3 casi di malattia pilonidale degenerata ed eseguirono una revisione della letteratura includendo i precedenti 41 casi di degenerazione maligna riportati fino ad allora. Di questi 44 casi in totale, 36 consistevano in carcinoma squamocellulare. Tutti i casi si erano verificati in malattia pilonidale di lunghissima durata, con una media di 23 anni. 5 pazienti su 6 con metastasi inguinali erano poi deceduti entro 16 mesi. 4 pazienti avevano ricevuto radioterapia adiuvante, 1 paziente aveva ricevuto chemioterapia adiuvante, ed 1 paziente aveva ricevuto un trattamento chemio-radioterapico neoadiuvante. 6 pazienti con recidiva erano stati sottoposti a resezioni curative e 3 pazienti erano sopravvissuti >10 anni senza evidenza di malattia.
Su tali basi, gli autori raccomandarono la chemio- e radioterapia neoadiuvante come una nuova modalità di trattamento per ridurre le percentuali di recidiva locale [22].
La degenerazione maligna della malattia pilonidale va quindi, nel suo complesso, considerata come una evenienza estremamente rara, ma possibile, specialmente se non trattata adeguatamente. La malattia pilonidale si risolve definitivamente (ferma restando la possibilità di recidiva/persistenza/nuova localizzazione) con la chirurgia.
INDICAZIONI
- La malattia pilonidale ascessualizzata deve essere sottoposta ad incisione e drenaggio, indipendentemente se si tratta di una presentazione de novo o una recidiva. La possibilità di exeresi della raccolta ascessuale in prima istanza o dell’utilizzo di tecniche mini-invasive (Endoscopic Pilonidal Abscess Treatment, EPAT) deve essere valutata in base alle condizioni cliniche locali (Livello di Evidenza 1; Grado di Raccomandazione B). Attualmente, è preferibile scegliere un trattamento elettivo una volta risolta la condizione acuta.
- Il trattamento della malattia pilonidale cronica è ancora controverso ed include l’utilizzo della tecnica aperta, della tecnica chiusa con sutura paramediana (“off-midline closure”) e gli approcci mini-invasivi.
Le tecniche mini-invasive sono efficaci e sicure nel trattamento della malattia pilonidale cronica e dovrebbero essere il trattamento di scelta per la malattia pilonidale limitata (singolo orifizio fistoloso o multipli sulla linea mediana) anche se in alcune casistiche viene messo in evidenza il loro ruolo anche per la malattia pilonidale recidiva o ascessualizzata [23, 24]. - In caso di tecnica chiusa, la sutura paramediana è la scelta consigliata perché associata a migliori risultati post-operatori rispetto alla chiusura mediana (Livello di Evidenza 1; Grado di Raccomandazione B). In questi casi, l’utilizzo di un eventuale drenaggio dipende dalla scelta del chirurgo.
- Fra le tecniche con sutura paramediana non esiste una scelta gold-standard, essendo tutte tecniche validate (Karidakis flap, Limberg flap, Cleft-Lift, V-Z flap, Z plasty).
- La gestione della malattia pilonidale recidiva è simile ad una presentazione de novo e la procedura chirurgica da eseguire dovrebbe essere scelta in base alle condizioni locali ed alle caratteristiche del paziente (Livello di Evidenza 1; Grado di Raccomandazione C).
- L’utilizzo degli antibiotici pre- e post-operatori hanno un impatto limitato su recidiva e guarigione della ferita (Livello di Evidenza 1; Grado di Raccomandazione B).
- Secondo il parere degli esperti, l’epilazione post-operatorio è raccomandata nei pazienti irsuti per ridurre il rischio di recidiva.
- Indipendentemente dal tipo di intervento chirurgico eseguito, una buona igiene post-operatoria è essenziali per una rapida guarigione della ferita senza complicanze.
TRATTAMENTO CHIRURGICO
La scelta del trattamento ideale dovrebbe essere guidata da una serie di principi:
- Semplice da eseguire;
- Basso tasso di ricorrenza;
- Minimo dolore postoperatorio e complicanze;
- Rapido ritorno alle attività quotidiane;
- Vantaggio costo/efficacia.
In base alle evidenze attuali non esiste un trattamento da considerare come gold-standard per il trattamento della malattia pilonidale. Infatti, la selezione viene eseguita in base alle caratteristiche del paziente (età, sesso, comorbidità), alle condizioni locali della malattia pilonidale (acuta o cronica, numero, estensione e localizzazione degli orifizi) ed all’esperienza del chirurgo.
INTERVENTI TRADIZIONALI
- Tecnica Aperta
Nonostante l’incredibile diffusione delle procedure mini-invasive, la tecnica aperta (exeresi e guarigione per seconda intenzione) resta l’approccio più utilizzato. Tuttavia, i principali limiti sono rappresentati dal prolungato tempo di guarigione con conseguente perdita di giorni lavorativi. I tassi di recidiva riportati in letteratura variano dal 2-6% al 15-35%. Questa grande discrepanza è dovuta alla selezione dei pazienti ed alla definizione di recidiva che ancora oggi non è chiara. Il tasso di recidiva risulta maggiore nei pazienti sottoposti ad exeresi per malattia pilonidale recidiva (20-42%) [25, 26].
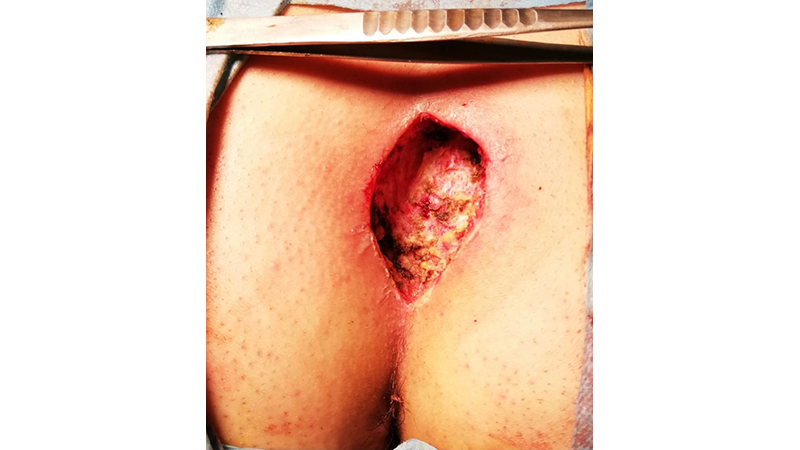
Figura 5. Exeresi e Guarigione per seconda intenzione. Foto del Dr. Gaetano Gallo
- Tecnica Semi-Aperta
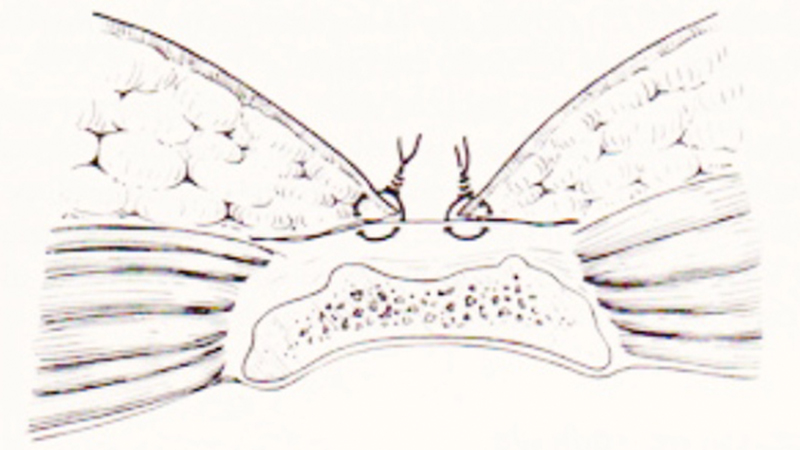
Figura 6. Marsupializzazione
- Tecnica Chiusa
Dopo exeresi e chiusura sulla linea mediana è riportato un tasso di deiscenza fra il 14% ed il 74%. Inoltre, il tasso di recidiva è più alto se comparato a tecniche come il flap secondo Limberg (4-45% vs 0-4%). Recentemente è stata proposta una tecnica di chiusura mediana senza tensione con un tasso di recidiva a 4 mesi del 4% [27].
In una meta-analisi [28] che include 13 studi che comparano l’escissione e guarigione per seconda intenzione con l’escissione con chiusura in prima istanza, gli autori hanno dimostrato una guarigione più rapida dopo sutura senza differenza di morbilità e con un rischio relativo di recidiva minore dopo escissione semplice. Secondo 6 studi che comparano la sutura mediana e la sutura paramediana, lo stesso autore ha concluso a favore di quest’ultima (guarigione più rapida, rischio infettivo e di recidiva minori) [29].
INTERVENTI MINI-INVASIVI
Si tratta di interventi “mirati” alla sola rimozione di tessuto pilonidale malacico ed appaiono la logica conseguenza della natura universalmente accettata come “acquisita” della malattia pilonidale. Possiamo affermare che tutti gli interventi mini-invasivi derivano dagli approcci di Lord e Millar e di Bascom.
- Intervento di Lord-Millar (1965)
- Intervento di Bascom (1980)
- Intervento di Sinotomia (2005, Al-Naami)
- Intervento di Gips (2008, modifica della Bascom)
- Intervento di Sinusectomia (2008-2011, Soll)
- Procedure Endoscopiche mini-invasive [EPSiT (2014, Meinero); VAAPS (2014, Milone); EPIC (2021, Baxter); EPAT (2016, Javed)]
- LASER (Palesty, 2000)
- Intervento di Carotaggio con cistectomia e fistulectomia (combina i principi e la tecnica dell’intervento di Bascom con quelli di Gips)
Procedure Hi-Tech
Gli interventi endoscopici mini-invasivi attualmente più frequenti sono la VAAPS (video-assisted ablation of pilonidal sinus) e la EPSiT (endoscopic pilonidal sinus treatment). Le due procedure sono basate sullo stesso concetto ma mentre la VAAPS si avvale di un isteroscopio con ottica di 30°, nella EPSiT viene utilizzato un fistoloscopio con un’ottica di 8°.
La procedura endoscopica prevede una prima fase diagnostica ed una seconda operativa.
La prima fase consente di visualizzare i tramiti principali e secondari della malattia pilonidale (dopo aver eseguito un’incisione di circa 0.5 cm, in modo da permettere l’ingresso del fistuloscopio. Una seconda incisione circolare potrebbe essere necessaria nell’eventualità di tramiti fistolosi multipli). In questa fase una soluzione di glicina/mannitolo 1% consente una migliore visualizzazione dei tramiti fistolosi ed il corretto funzionamento dell’elettrodo monopolare.
Lo scopo della seconda fase operativa è distruggere e bonificare l’intera area patologica. Attraverso il fistuloscopio viene introdotta una sottile pinza che consente di rimuovere, sotto visione, i peli contenuti, compresi i loro follicoli. Questa manovra è fondamentale per la guarigione. Una volta eseguito questo step, le pinze vengono sostituite da un elettrodo monopolare mediante il quale l’intera area, tramiti secondari ed eventuali cavità ascessuali, vengono completamente cauterizzati e distrutti. Il materiale necrotico viene poi rimosso mediante una spazzola endoscopica (“endobrush”), sempre passante attraverso il fistuloscopio, o mediante un cucchiaio di Volkmann. Al termine, e sempre sotto visione, si riutilizza l’elettrodo per completare l’emostasi evitando così il sanguinamento postoperatorio.
Recentemente Giordano e colleghi hanno associato alla EPSiT l’utilizzo di una terapia a pressione negativa per ridurre il tempo di guarigione della ferita e favorire la ripresa lavorativa [30].
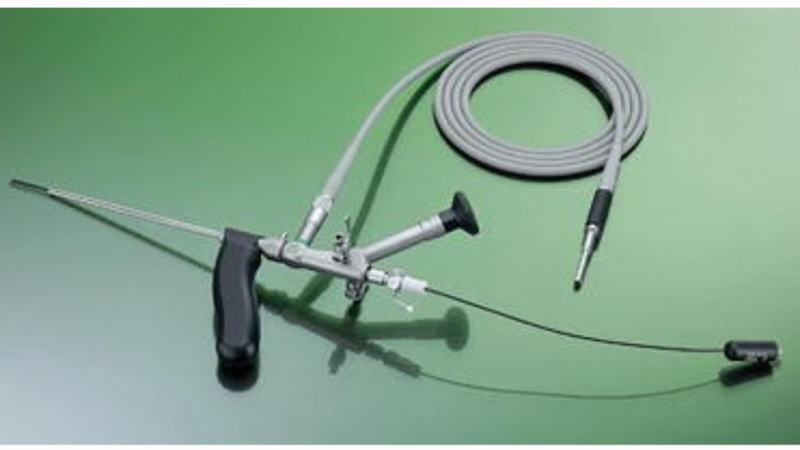
Figure 7. Il fistuloscopio utilizzato nella EPSiT. Da Meinero et al [31]
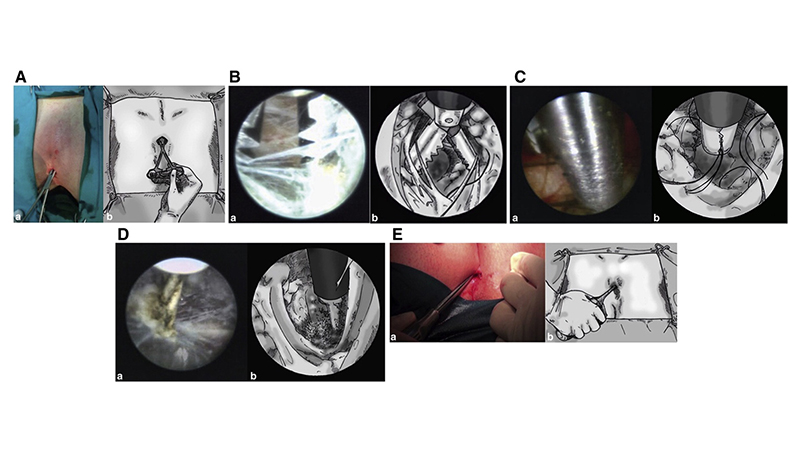
Figura 8. VAAPS. Da Milone et al [33]
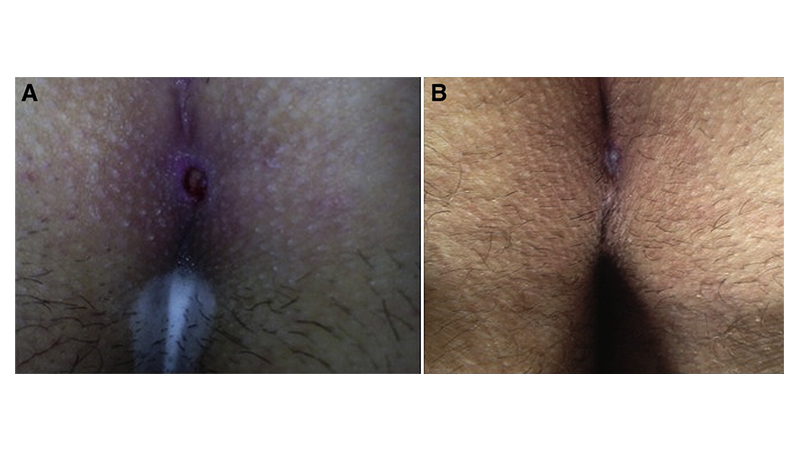
Figura 9. La ferita nel 2° (a) e 12° (b) giorno post-operatorio. Da Milone et al [33]
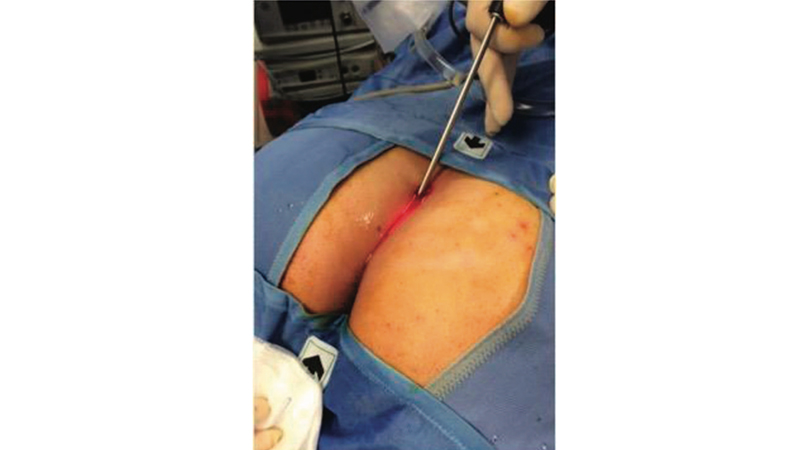
Figura 10. Introduction of the fistuloscope trough the external opening and initiation of diagnostic step. Da Giarratano et al [32].
La prima descrizione relativa all’utilizzo dei LASER nella malattia pilonidale è stata riportata da Palesty nel 2000 [34].
A più di 10 anni di distanza lo stesso sistema utilizzato per il trattamento delle fistole perianali (FILAC) è stato adottato per la malattia pilonidale con l’acronimo di SiLAC (Sinus Laser Closure) [35]. Il vantaggio della tecnica consiste nella distribuzione omogenea dell’energia a 360° con una profondità di penetrazione di circa 2-3 mm evitando così un danno alle strutture circostanti. Altre varianti sono state descritte in letteratura con altri acronimi come PiLAT (Pilonidal Disease Laser Treatment) o SiLAT (Sinus Laser Therapy).
Il principio di questo trattamento è quello di provocare un’obliterazione del tragitto fistoloso. Attualmente la maggior limitazione è costituita dall’assenza di una visione magnificata al contrario delle tecniche endoscopiche.
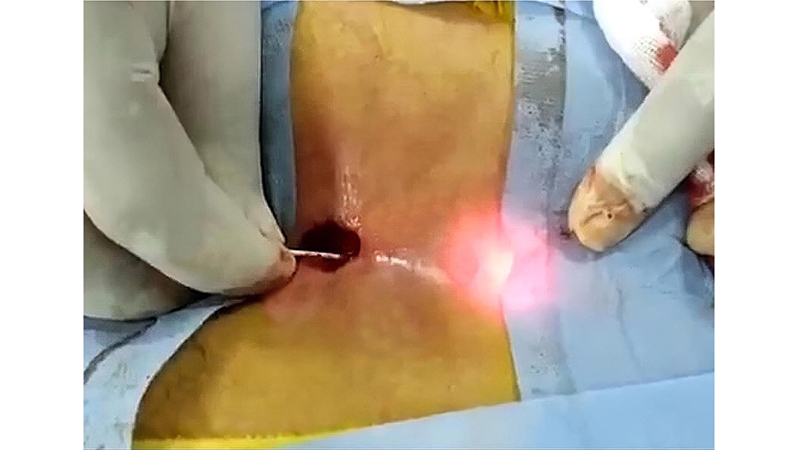
Figure 11. The radial diode laser fiber inside the tract. Da Algazar M et al [36]
Procedure Non-Hi-Tech
Un’altra delle tecniche mini-invasive non endoscopiche molto diffusa è l’approccio secondo Gips, descritto nel 2008 [37], che si avvale di punch da biopsia (da 3-8 mm) per eseguire un “carotaggio”, il più selettivo possibile, dei tessuti patologici possibile asportando esclusivamente la cisti e i tramiti fistolosi.

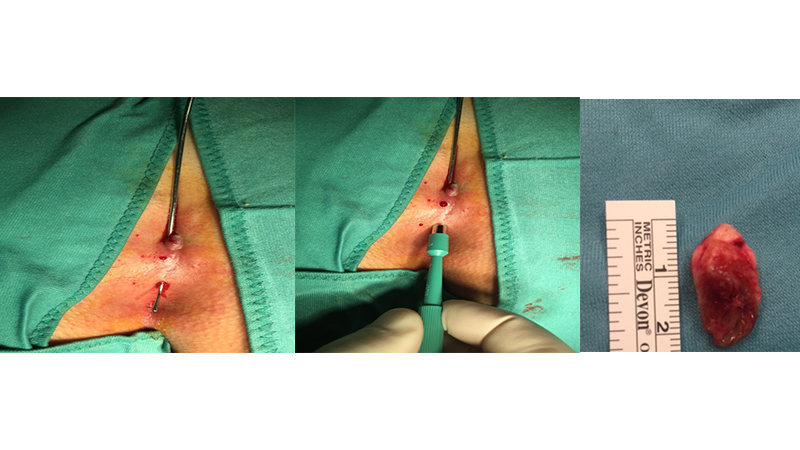
Figure 12. Tecnica di Bascom-Gips. Foto del Prof. Luigi Basso (Università “La Sapienza”, Roma)
INTERVENTI DI CHIRURGIA PLASTICA
- Plastica a “Z”
- Cleft Lift o “Bascom 2”
- Flap Romboide
- Flap di Karydakis
- Flap di Limberg
- Flap Gluteo Massimo
- Flap di Avanzamento Gluteo Bilaterale
- Flap V-Y
- Flap dell’Arteria Perforante Glutea Superiore
- Flap Triangolari Incrociati
- Flap di Dufourmentel modificato con peduncolo superiore.
La plastica a Z, il flap V-Y ed il flap di Dufourmentel hanno risultati simili alle procedure descritte da Karidakis, Limberg ed alla Cleft-Lift. Tuttavia, non sono state ampiamente accettate e diffuse.
Uno studio randomizzato di Fazeli et al [38], che compara la guarigione per seconda intenzione con la plastica a Z, non ha dimostrato nessuna differenza tra le due tecniche in termini di morbilità e di recidive a lungo termine con un follow-up di 22 mesi.
La tecnica di “Clef-Lift” è stata descritta da Bascom modificando il flap di Karydakis nei primi anni 80’. Il tasso di recidiva varia fra lo 0 ed il 5% a 10 anni con una deiscenza della ferita spesso causata da una infezione del sieroma sottocutaneo che si verifica nel 15-40% dei casi.
Immerman ha recentemente pubblicato la sua casistica relativa a 700 procedure consecutive fra il 1993 ed il 2020. Il tasso di successo è stato del 96.6% con una infezione della ferita in 18 pazienti (2.6%) ed un ematoma in 8 pazienti (1.1%) [39].
19 pazienti hanno richiesta la ripetizione di una seconda Clef-lift, di cui 5 pazienti che non sono guariti, sono stati sottoposti ad una terza procedura. E’ una delle tecniche con sutura paramediana da preferire, insieme al flap di Limberg e Karydakis, anche se il risultato cosmetico resta uno dei punti maggiormente controversi [40].
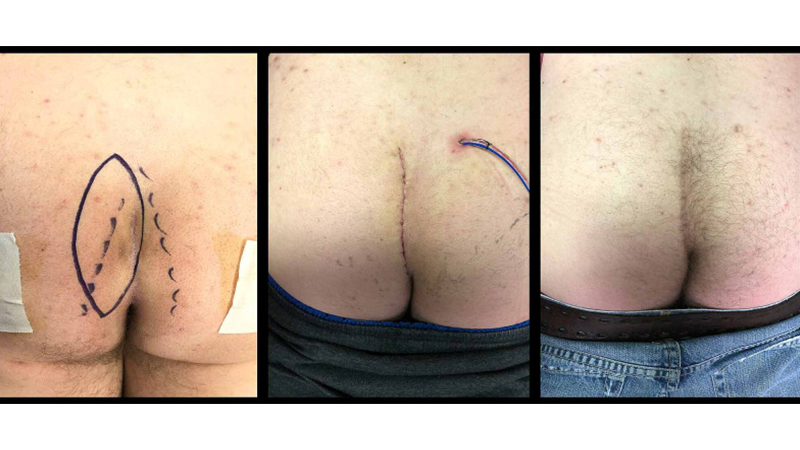
Figura 13. La “Cleft-Lift” in un paziente con pregressi ascessi da MP. Da sinistra verso destra: Incisione ellittica; follow-up a 7 giorni dall’intervento; follow-up ad 1 anno dall’intervento. Da Immerman [39].
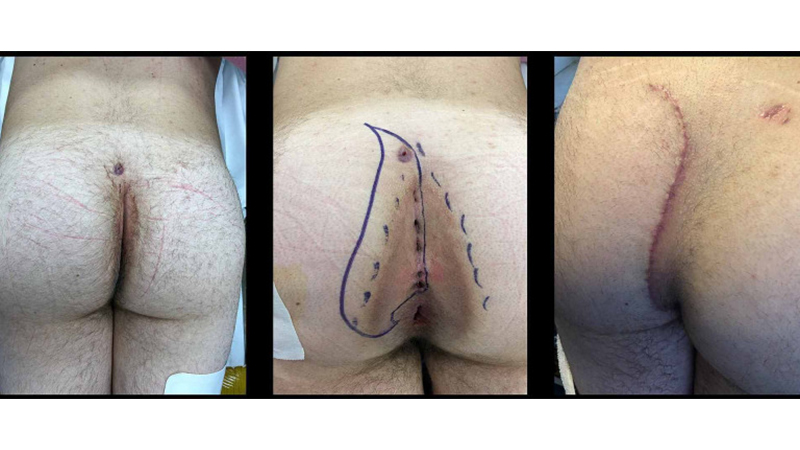
Figura 14. La “Cleft-Lift” in un paziente con malattia perianale. Da sinistra verso destra: preoperatorio; area proposta per exeresi; follow-up a 6 settimane dall’intervento. Da Immerman [39].
Il flap romboide è stato descritto per la prima da un chirurgo russo, Alexander Limberg, nel 1945 anche se il primo report scientifico risale a circa 20 anni dopo [41].
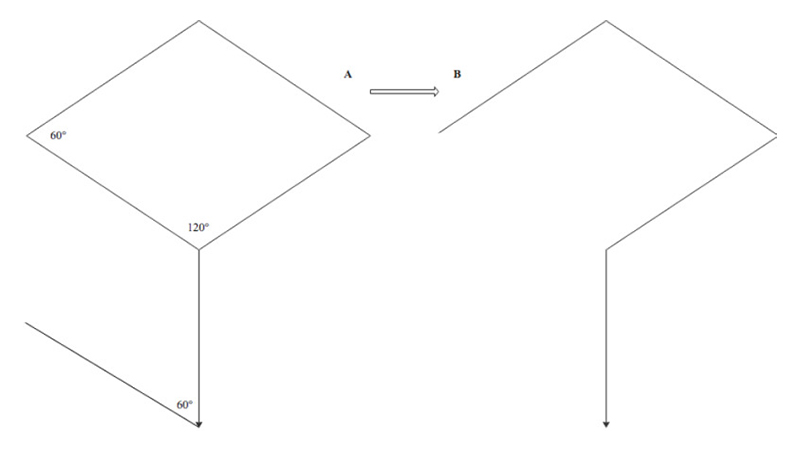
Figura 15. Flap di Limberg. Da Macneal P et al [42]
Successivamente, il flap di Limberg è stato modificato così che l’incisione romboidale risulti asimmetrica ed il polo inferiore del flap sia 1-2 cm laterale alla linea mediana. Questo accorgimento ha consentito di ridurre il tasso di recidive [43].
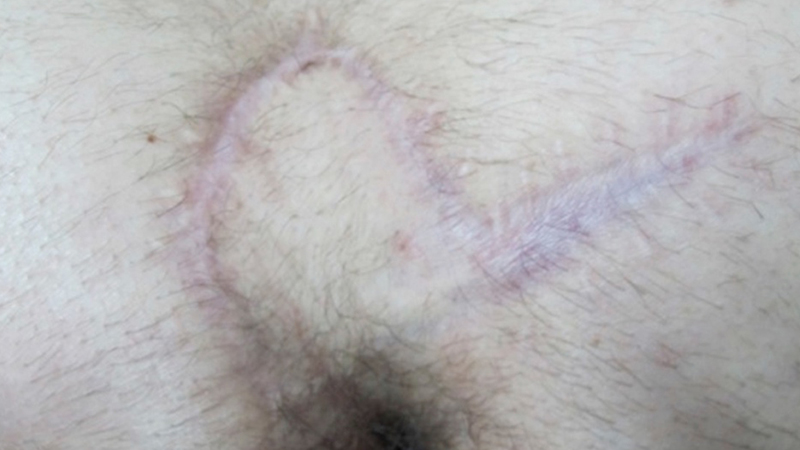
Figura 16. Limber flap ad 1 anno. Da Omer et al [44]
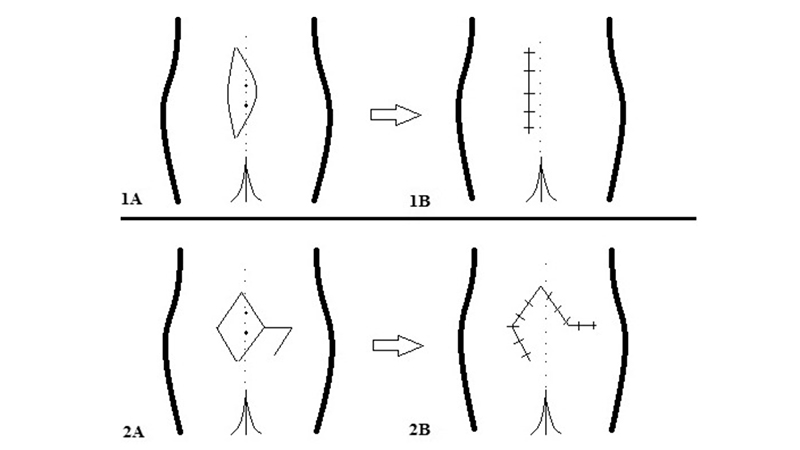
Figura 17. Karydakis (1A, 1B) e Limberg Flap (2A, 2B). Da Tokac et al [45]
Secondo una recente revisione sistematica, che ha incluso 39 studi e 5.061 pazienti, il flap di Limberg è risultato essere il più utilizzato con il tasso di recidiva minore ed il flap di Karydakis è stato associato ad un tempo operatorio minore.
La tecnica aperta era la migliore in termini di tasso di infezione. Il tasso di recidiva dopo chiusura mediana ha raggiunto il 67.9% a 20 anni [46].
Romaniszyn e colleghi hanno comparato il flap di Limberg con l’EPSiT in 62 pazienti con malattia pilonidale complicata (36 vs 26 pazienti, rispettivamente) con un follow-up mediano di 27 mesi. Il tasso di successo è stato a favore del flap di Limberg (94.1% vs 57.7%) anche se con una percentuale di complicanze maggiore (11.5% vs 26.5%) [47].
TESTI SUGGERITI
- Linee Guida della Società Italiana di Chirurgia Colorettale (SICCR)
https://link.springer.com/article/10.1007%2Fs10151-021-02487-8 - Rischio di progressione neoplastica in malattia pilonidale cronica
https://wjso.biomedcentral.com/articles/10.1186/s12957-017-1129-0 - EPSiT per malattia pilonidale recidiva
https://link.springer.com/article/10.1007%2Fs00384-019-03256-8 - Tecnica Aperta vs Chiusa
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006213.pub3/full - VAAPS vs Cleft-Lift
https://jamanetwork.com/journals/jamasurgery/fullarticle/2484564 - Revisione sistematica e Meta-analisi sui trattamenti chirurgici per malattia pilonidale
https://www.nature.com/articles/s41598-020-70641-7
VIDEO SUGGERITI (dal Canale YouTube di Colorectal Disease)
- 3 procedure che ogni chirurgo colorettale dovrebbe conoscere
https://www.youtube.com/watch?v=UR3iyMLPfd4 - VAAPS
https://www.youtube.com/watch?v=HZJWeJ0HjcU&t=14s
BIBLIOGRAFIA
- Mayo OH (1833) Observations on injuries and diseases of the rectum. London: Burgess and Hill 45-46
- Anderson AW (1847) Hair extracted from an ulcer. Boston Med Surg J 36: 74-6
- Warren JM. (1854) Abscess, containing hair, on the nates. Am J Med Sci 28: 113
- Hodges RM. Pilonidal sinus. Boston Med Surg J. 1880;103: 485–586.
- Corman ML, Nicholls RJ, Fazio VW, Bergamaschi R (2012) Corman’s Colon and Rectal Surgery. 6th ed. Philadelphia: Lippincott Williams & Wilkins pp. 195-203
- Bascom J (2008) Surgical treatment of pilonidal disease. Off-midline sutures improve outcomes compared with midline sutures. BMJ 336: 842-3
- Soullard J, Contou JF. (1983) Colo-proctologie. Paris: Masson (473p)
- BergerA, Frileux P. (1995) Sinus pilonidal. Ann Chir 49:889-901
- Davage ON (1954) The origin of sacrococcygeal pilonidal sinuses: based on an analysis of four hundred sixty-three cases. Am J Pathol 30:1191–1205
- Lannelongue O (1882) Memoir sur les fistules et les depression cutannes congenitals inferieures. Observation d’un kyste dermoid de la region sacro- coccygene. Bull Soc Chir Paris 8:185–194
- Fere C (1878) Cloisonement de la cavite pelvienne; uterus et vagina doubles; infunibulum cutane de la region sacroccygienne. Bull Soc Anat Paris 3: 309–312
- Buie LA (1944) Jeep-disease. South Med J 37:103-109
- Bascom J (1980) Pilonidal disease: origin from follicles of hairs and results of follicle removal as treatment. Surgery 87: 567-72
- Akinci OF, Kurt M, Terzi A, Atak I, Subasi IE, Akbilgic O (2009) Natal cleft deeper in patients with pilonidal sinus: implications for choice of surgical procedure. Dis Colon Rectum 52(5):1000-2
- Karydakis GE (modificato) (1992) Easy and successful treatment of pilonidal sinus after explanation of its causative process. Aust NZ J Surg 62:385–9
- Karydakis GE (1973) New approach to the problem of pilonidal sinus. Lancet 2(7843):1414-5
- Tezel E (2007) A new classification according to navicular area concept for sacrococcygeal pilonidal disease. Colorectal Dis 9(6):575–576
- Guner A, Cekic AB, Boz A, Turkyilmaz S, Kucuktulu U (2016) A proposed staging system for chronic symptomatic pilonidal sinus disease and results in patients treated with stage-based approach. BMC Surg 16:18
- Aysan E, Ilhan M, Bektas H, Kaya EA, Sam B, Buyukpinarbasili N, Muslumanoglu M. Prevalence of sacrococcygeal pilonidal sinus as a silent disease. Surg Today. 2013 Nov;43(11):1286-9. doi: 10.1007/s00595-012-0433-0
- Sondenaa K, Andersen E, Nesnik I, Soreide A. (1995) Patient characteristics and symptoms in chronic pilonidal disease. Int J Colorect Dis 10: 39-42
- Milone M, Basso L, Manigrasso M, Pietroletti R, Bondurri A, La Torre M, Milito G, Pozzo M, Segre D, Perinotti R, Gallo G. Consensus statement of the Italian society of colorectal surgery (SICCR): management and treatment of pilonidal disease. Tech Coloproctol. 2021 Jun 27. doi: 10.1007/s10151-021-02487-8. Epub ahead of print. PMID: 34176001.
- Davis KA, Mock CN, Versaci A, Lentrichia P. (1994) “Malignant degeneration of pilonidal cysts”. Am Surg 60:200-4
- Meinero P, La Torre M, Lisi G, Stazi A, Carbone A, Regusci L, Fasolini F. Endoscopic pilonidal sinus treatment (EPSiT) in recurrent pilonidal disease: a prospective international multicenter study. Int J Colorectal Dis. 2019 Apr;34(4):741-746
- Javed MA, Fowler H, Jain Y, Singh S, Scott M, Rajaganeshan R. Comparison of conventional incision and drainage for pilonidal abscess versus novel endoscopic pilonidal abscess treatment (EPAT). Tech Coloproctol. 2016 Dec;20(12):871-873. doi: 10.1007/s10151-016-1546-z
- Doll D (2007) Sinotomy versus excisional surgery for pilonidal sinus. ANZ J Surg 77:599–600
- Iesalnieks I, Fürst A, Rentsch M, Jauch KW (2003) Primary midline closure after excision of a pilonidal sinus is associated with a high recurrence rate. 74(5):461–468
- Sevinc B, Karahan O, Okus A et al (2016) Randomized prospective comparison of midline and off-midline closure techniques in pilonidal sinus surgery. Surgery 159:749–754
- McCallum IJD., King P.M, Bruce J, Bascom (2008) Healing by Primary Closure versus Open Healing after Surgery for Pilonidal Sinus: Systematic Review and Meta-Analysis. British Medical Journal Vol. 336, No. 7649, pp. 868-871
- Al-Khamis A, McCallum I, King PM, Bruce J. Healing by primary versus secondary intention after surgical treatment for pilonidal sinus. Cochrane Database Syst Rev. 2010 Jan 20;2010(1):CD006213. doi: 10.1002/14651858.CD006213.pub3
- Giordano P, Schembari E, Keshishian K, Leo CA. Negative pressure-assisted endoscopic pilonidal sinus treatment. Tech Coloproctol. 2021 Jun;25(6):739-743. doi: 10.1007/s10151-021-02431-w
- Meinero P, Mori L. Video-assisted anal fistula treatment (VAAFT): a novel sphincter-saving procedure for treating complex anal fistulas. Tech Coloproctol. 2011 Dec;15(4):417-22. doi: 10.1007/s10151-011-0769-2
- Giarratano G, Toscana C, Shalaby M, Buonomo O, Petrella G, Sileri P. Endoscopic Pilonidal Sinus Treatment: Long-Term Results of a Prospective Series. 2017 Jul-Sep;21(3):e2017.00043. doi: 10.4293/JSLS.2017.00043
- Milone M, Musella M, Di Spiezio Sardo A, et al. Video-assisted ablation of pilonidal sinus: a new minimally invasive treatment–a pilot study. Surgery 2014; 155:562–566. https://doi.org/10.1016/j.surg.2013.08.021
- Palesty JA, Zahir KS, Dudrick SJ, Ferri S, Tripodi G. Nd:YAG laser surgery for the excision of pilonidal cysts: a comparison with traditional techniques. Lasers Surg Med. 2000;26(4):380-5. doi: 10.1002/(sici)1096-9101(2000)26:4<380::aid-lsm6>3.0.co;2-x
- Dessily M, Charara F, Ralea S, Allé JL. Pilonidal sinus destruction with a radial laser probe: technique and first Belgian experience. Acta Chir Belg. 2017 Jun;117(3):164-168. doi: 10.1080/00015458.2016.1272285
- Algazar M, Zaitoun MA, Khalil OH, Abdalla WM. Sinus laser closure (SiLaC) versus Limberg flap in management of pilonidal disease: A short term non-randomized comparative prospective study. Asian J Surg. 2021 May 6:S1015-9584(21)00243-8. doi: 10.1016/j.asjsur.2021.04.026
- Gips M, Melki Y, Salem L, Weil R, Sulkes J (2008) Minimal surgery for pilonidal disease using trephines: description of a new technique and long-term outcomes in 1,358 patients. Dis Colon Rectum 51:1656–1662
- Fazeli MS, Adel MG, Lebaschi AH. (2006) Comparison of outcomes in Z-plasty and delayed healing by secondary intention of the wound after excision of the sacral pilonidal sinus: results of a randomized clinical trial. Dis Colon Rectum 49:1831-6
- Immerman SC. The Bascom Cleft Lift as a Solution for All Presentations of Pilonidal Disease. Cureus. 2021 Feb 1;13(2):e13053. doi: 10.7759/cureus.13053
- Immerman SC. Patient Satisfaction After the Cleft-Lift Procedure. Cureus. 2021 Sep 3;13(9):e17686. doi: 10.7759/cureus.17686
- Limberg AA. Design of local flaps. Mod Trends Plast Surg. 1966;2:38-61
- Macneal P, Adlard RE. Rhombic Flaps. 2021 Jul 31. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan–. PMID: 32644357
- Mentes BB, Leventoglu S, Cihan A, Tatlicioglu E, Akin M, Oguz M. Modified Limberg transposition flap for sacrococcygeal pilonidal sinus. Surg Today. 2004;34(5):419-23. doi: 10.1007/s00595-003-2725-x
- Omer Y, Hayrettin D, Murat C, Mustafa Y, Evren D. Comparison of modified limberg flap and modified elliptical rotation flap for pilonidal sinus surgery: a retrospective cohort study. Int J Surg. 2015 Apr;16(Pt A):74-77. doi: 10.1016/j.ijsu.2015.02.024
- Tokac M, Dumlu EG, Aydin MS, Yalcın A, Kilic M. Comparison of modified Limberg flap and Karydakis flap operations in pilonidal sinus surgery: prospective randomized study. Int Surg. 2015 May;100(5):870-7. doi: 10.9738/INTSURG-D-14-00213.1
- Bi S, Sun K, Chen S, Gu J. Surgical procedures in the pilonidal sinus disease: a systematic review and network meta-analysis. Sci Rep. 2020 Aug 13;10(1):13720. doi: 10.1038/s41598-020-70641-7
- Romaniszyn M, Swirta JS, Walega PJ. Long-term results of endoscopic pilonidal sinus treatment vs Limberg flap for treatment of difficult cases of complicated pilonidal disease: a prospective, nonrandomized study. Colorectal Dis. 2020 Mar;22(3):319-324. doi: 10.1111/codi.14857
Approfondimento a cura di:
Il Dottor Gallo Gaetano ha conseguito la Laurea in Medicina e Chirurgia nel 2012 presso l’Università degli Studi “Magna Graecia” di Catanzaro, con la successiva specializzazione in Chirurgia Generale. Ha...
Leggi la Bio


